
水是生命之源,也是化学反应中的主角。请回答下列问题:
I.水是一种电解质,发生电离会产生电子总数相同的两种微粒,其电离方程式为 。
Ⅱ.在许多反应中H2O扮演不同的“角色”。请结合所学知识,写出有关反应的化学方程式或离子方程式。
(1)H2O参与置换反应,符合X+W→Y+V:
已知X和Y分别是短周期主族元素形成的两种单质, W、V是化合物。
①W是水,作还原剂,该反应的化学方程为 ;
②V是水,化学方程式为 。
(2)水在氧化还原反应既不是氧化剂也不是还原剂:
A、B是中学化学常见的两种由短周期元素组成的有色气体,它们均能与水发生氧化还原反应,但水既不是氧化剂也不是还原剂,写出A、B与水反应的化学方程式:
①A + H2O ;
②B + H2O ;
(3)某物质化学式为NH5,常温下是固态,能与水剧烈反应放出两种气体。在NH5中的各原子均具有稀有气体的稳定结构,则下列对NH5与水的反应描述正确的是 (填选项)。
A.NH5与水反应时,NH5是氧化剂
B.NH5与水反应时,NH5既是氧化剂又是还原剂
C.NH5与水反应时,NH5是还原剂
D.NH5与NH3溶于水后溶液均呈碱性
I.H2O+H2O
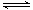 OH- +H3O+ (2分)
OH- +H3O+ (2分)
Ⅱ.(1)①2F2 +2H2O =O2 +4HF (2分) ②O2+2H2S=S+2H2O (2分)
(2)①Cl2 +H2O = HCl + HClO (2分) ②3NO2 +H2O = 2HNO3 + NO (2分)
(3)C D (2分,各1分)
说明:若所涉及的答案可能有多种,符合题意均给分。
【解析】
试题分析:I.水电离生成电子总数相同的两种微粒,为OH‾和H3O+。
Ⅱ.(1)①水做还原剂,应与比O2氧化性更强的F2反应,②H2O为产物,O2与H2S置换可生成H2O。
(2)高中化学学过的有颜色气体,能与水发生氧化还原反应,但水既不是氧化剂也不是还原剂,为Cl2和NO2。
(3)NH5为NH4H,NH4+与H‾结合的离子化合物,与水反应时,H‾化合价升高,H2O中的H化合价降低,生成H2和NH3, NH5为还原剂,H2O为氧化剂。
考点:本题考查水的电离、氧化还原反应以及物质的性质。


科目:高中化学 来源: 题型:阅读理解
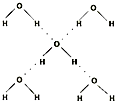
| 键型 | 键能 (kJ/mol) |
键长 (pm) |
分子 | 键角 | 物质 | 熔点(℃) | 沸点(℃) |
| H-C | 413 | 109 | 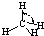 |
109.5° | 甲烷 | -183.7 | -128.0 |
| H-N | 391 | 101 | 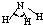 |
107° | 氨 | -77.7 | -33.3 |
| H-O | 467 | 96 | 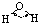 |
104.5° | 水 | 0.0 | 100.0 |
查看答案和解析>>
科目:高中化学 来源:黑龙江省哈尔滨三中2010届高三9月月考化学试题 题型:022
水是生命之源,也是一种常用的试剂.请回答下列问题:
(1)水分子中氧原子在基态时核外电子排布式为________.
(2)H2O分子中氧原子采取的是________杂化.
(3)水分子容易得到一个H+形成水合氢离子(H3O+).对上述过程的下列描述不合理的是________.
A.氧原子的杂化类型发生了改变
B.微粒的空间构型发生了改变
C.微粒中的键角发生了改变
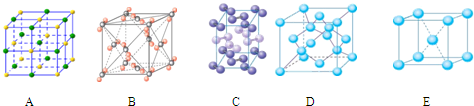
(4)下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(未按顺序排序).与冰的晶体类型相同的是________.(请用相应的编号填写)

(5)在冰晶体中,每个水分子与相邻的4个水分子形成氢键(如图所示),已知冰的升华热是51 kJ/mol,除氢键外,水分子间还存在范德华力(11 kJ/mol),则冰晶体中氢键的“键能”是________kJ/mol.
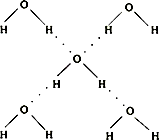
(6)将白色的无水CuSO4溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配合离子.请写出生成此配合离子的离子方程式:________.
查看答案和解析>>
科目:高中化学 来源:2012-2013年辽宁实验中学分校高二下学期阶段性测试化学试卷(带解析) 题型:填空题
水是生命之源,也是一种常用的试剂。请回答下列问题:
(1)水分子中氧原子在基态时核外电子排布式为___ _______;
(2)H2O分子中氧原子采取的是 杂化。
(3)水分子容易得到一个H+形成水合氢离子(H3O+)。对上述过程的下列描述不合理的是 。
| A.氧原子的杂化类型发生了改变 | B.微粒的形状发生了改变 |
| C.水合氢离子分子构型是三角锥型 | D.微粒中的键角发生了改变 |
查看答案和解析>>
科目:高中化学 来源:2014届辽宁实验中学分校高二下学期阶段性测试化学试卷(解析版) 题型:填空题
水是生命之源,也是一种常用的试剂。请回答下列问题:
(1)水分子中氧原子在基态时核外电子排布式为___ _______;
(2)H2O分子中氧原子采取的是 杂化。
(3)水分子容易得到一个H+形成水合氢离子(H3O+)。对上述过程的下列描述不合理的是 。
A.氧原子的杂化类型发生了改变 B.微粒的形状发生了改变
C.水合氢离子分子构型是三角锥型 D.微粒中的键角发生了改变
(4)将白色的无水CuSO4溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配合离子。请写出生成此配合离子的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
水是生命之源,也是一种常用的试剂。请回答下列问题:
(1)水分子中氧原子在基态时核外电子排布式为 。
(2)H2O分子中氧原子采取的是 杂化。
(3)水分子容易得到一个H+形成水合氢离子(H3O+)。对上述过程的下列描述不合理的是 。
A.氧原子的杂化类型发生了改变 B.微粒的空间构型发生了改变
C.微粒中的键角发生了改变
(4)下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(未按顺序排序)。与冰的晶体类型相同的是______。(请用相应的编号填写)
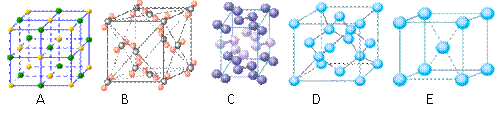 |

(5)在冰晶体中,每个水分子与相邻的4个水分子形成氢键(如图所示),已知冰的升华热是51 kJ/mol,除氢键外,水分子间还存在范德华力(11 kJ/mol),则冰晶体中氢键的“键能”是_________kJ/mol。
(6)将白色的无水CuSO4溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配合离子。请写出生成此配合离子的离子方程式: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com