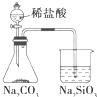
分析:(1)平衡常数等于生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积,根据方程式计算c
2、c
1,据此解答;60s后反应达平衡,反应混合物各组分的浓度不变;
(2)依据起始浓度,平衡浓度和图表中的浓度,描点画出变化图象;
(3)由表可知,60s时反应达平衡,根据方程式计算△c(N
2O
4),依据化学反应速率V=
计算得到;
(4)依据平衡浓度计算平衡常数,结合化学平衡三段式列式计算,转化率=
×100%,依据化学平衡原理分析改变条件提高NO
2转化率的选项.
解答:
解:(1)N
2O
4(g)?2NO
2(g),反应的平衡常数K=
;
20s时c(NO
2)=0.060mol/L
N
2O
4?2 NO
2,
浓度变化 0.030mol 0.060mol/L
c
1=0.10mol/L-0.03mol/L=0.070mol/L;
由表可知,40s时,c(N
2O
4)=0.050mol/L,
N
2O
4?2 NO
2,
浓度变化:(0.1-0.05)mol/L 0.10mol/L
所以c
2=0.10mol/L
由表可知,60s时,c(NO
2)=0.120mol/L
N
2O
4?2 NO
2,
浓度变化 0.010mol 0.020mol/L
c
3=0.05mol/L-0.01mol/L=0.04mol/L;
由表可知,80s时,c(NO
2)=0.120mol/L
c
4=0.04mol/L;
所以c
2>c
1;c
3=c
4故答案为:
;<;=;
(2)依据图表中物质的浓度在坐标系中描点画出变化图象,平衡状态(NO
2)=0.120mol/L,c(N
2O
4)=0.10mol/L-0.060mol/L=0.04mol/L,得到的图象为:
,答:

;
(3)由表可知,60s时反应达平衡,c(NO
2)=0.120mol/L,
N
2O
4?2 NO
2,
浓度变化:0.06mol/L 0.120mol/L
V(N
2O
4)=
=0.001mol/(L?s);
故答案为:0.001mol/(L?s);
(4)依据平衡浓度计算平衡常数,
N
2O
4?2 NO
2,
起始量(mol/L) 0.10 0
变化量(mol/L) 0.06 0.12
平衡量(mol/L) 0.04 0.12
K=
=0.36
若起始时充入N0
2气体0.200mol,设消耗二氧化氮物质的量浓度为x,2 NO
2=N
2O
4 ,K=
2 NO
2=N
2O
4 起始量(mol/L) 0.200 0
变化量(mol/L) x 0.5x
平衡量(mol/L) 0.200-x 0.5x
K=
=
x=0.08mol/L
则达到平衡时N0
2气体的转化率=
×100%=40%
2 NO
2=N
2O
4 反应是气体体积减小的放热反应,依据化学平衡原理分析选项,增大二氧化氮转化率的条件;
A.减小NO
2的浓度,平衡逆向进行,二氧化氮转化率减小,故A不符合;
B.降低温度,平衡正向进行,二氧化氮转化率增大,故B符合;
C.增加NO
2的浓度,恒容容器中相当于增大压强,平衡正向进行,二氧化氮转化率增大,故C符合;
D.升高温度,平衡逆向进行,二氧化氮转化率减小,故D不符合;
E.再充入一定量的He,总爱增大,气体分压不变,平衡不变,二氧化氮转化率不变,故E不符合;
故答案为:40%;BC.

 已知:N2O4(g)=2NO2(g);△H=+57.20kJ?mol-1.
已知:N2O4(g)=2NO2(g);△H=+57.20kJ?mol-1. ,答:
,答: ;
;