
【题目】下列方程式书写正确的是
A.HCO3-在水溶液中的电离方程式:HCO3-+H2O![]() H3O++CO32-
H3O++CO32-
B.乙烷燃烧热的热化学方程式:2C2H6(g)+7O2(g)=4CO2(g)+6H2O(l) ΔH=-2319.6 kJ/mol
C.CO32-的水解方程式:CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
D.CaCO3的溶解方程式:CaCO3(s)=Ca2+(aq)+CO32-(aq)
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】下列实验设计不合理的是
A. 自制“84”消毒液
自制“84”消毒液
B.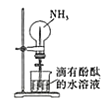 利用喷泉实验探究NH3的部分性质
利用喷泉实验探究NH3的部分性质
C. 制备Fe(OH)2白色沉淀
制备Fe(OH)2白色沉淀
D.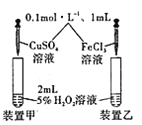 探究不同催化剂对双氧水分解速率的影响
探究不同催化剂对双氧水分解速率的影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锰及其化合物在现代工业、农业生产中有着广泛的应用,同时也是实验室中常用的重要试剂。
(1)KMnO4是强氧化剂,其溶液中c(H+)=c(OH-),则常温下0.01molL-1的HMnO4溶液的pH=_____________。
(2)MnS常用于除去污水中的Pb2+等重金属离子:Pb2+(aq)+ MnS(s)PbS(s)+Mn2+(aq),若经过处理后的水中c(Mn2+)=1 ×10-6 molL-1,则c(Pb2+)=______________[已知Ksp(PbS)=8×10-28、Ksp(MnS)=2×10-13]。
(3)锰是农作物生长的重要微量元素,用硫酸锰溶液拌种可使农作物产量提高10%~15%。某工厂利用回收的废旧锌锰干电池生成硫酸锰晶体(MnSO4H2O)的流程如图所示:
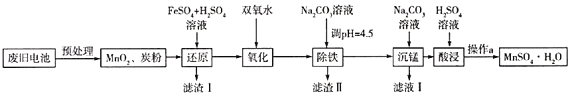
①MnSO4中含有的化学键类型有_______________。
②滤渣Ⅱ的主要成分是____________,滤渣Ⅰ是一种黑色单质,“还原”过程中氧化产物是Fe3+,写出相应反应的离子方程式_________,此反应中MnO2的转化率与温度之间的关系如图所示,则适宜的温度是______________(填字母)。
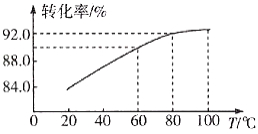
a.40 ℃ b.60 ℃ c.80 ℃ d.100 ℃
③“沉锰”中有无色无味的气体生成,还有MnCO36Mn(OH)25H2O生成,写出相应反应的化学方程式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表述与示意图一致的是
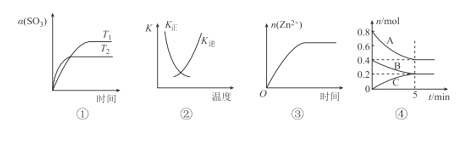
A.图①表示2SO3(g)=2SO2(g)+O2(g) △H>0,SO3的平衡转化率随温度、时间的变化
B.图②中曲线表示反应H2(g)+I2(g)=2HI(g) △H<0正、逆反应的平衡常数K随温度的变化
C.图③表示20 mL 0.1 mol/L稀盐酸与过量锌粒混合时,n(Zn2+)随时间的变化
D.图④反应从开始到平衡的平均反应速率v(B)=0.04molL-1min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1)NH4Al(SO4)2可作净水剂,其理由是_______________(用必要的化学用语和相关文字说明)。
(2)相同条件下,0.1 mol/L NH4Al(SO4)2中的c(NH![]() )________(填“等于”“大于”或“小于”)0.1 mol/L NH4HSO4中的c(NH
)________(填“等于”“大于”或“小于”)0.1 mol/L NH4HSO4中的c(NH![]() )。
)。
(3)如图是0.1 mol/L电解质溶液的pH随温度变化的图像。

①其中符合0.1 mol/L NH4Al(SO4)2的pH随温度变化的曲线是________(填写字母),导致pH随温度变化的原因是___________________;
②20℃时,0.1 mol/L NH4Al(SO4)2中2c(SO![]() )-c(NH
)-c(NH![]() )-3c(Al3+)=________。
)-3c(Al3+)=________。
(4)室温时,向100 mL 0.1 mol/L NH4HSO4溶液中滴加0.1 mol/L NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示:

试分析图中a、b、c、d四个点,水的电离程度最大的是________;在b点,溶液中各离子浓度由大到小的排列顺序是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五氧化二钒用作冶金添加剂,占五氧化二钒总消耗量的 80%以上,其次是用作有机化工的催化剂。为了增加V2O5 的利用率,我们从废钒催化剂(主要成分V2O5、VOSO4、K2SO4、SiO2 和Fe2O3 等) 中回收 V2O5 的一种生产工艺流程示意图:
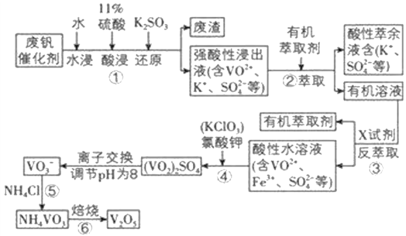
部分含钒物质在水中的溶解性如表所示,回答下列问题:
物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
(1)①中废渣的主要成分是 __________________________;①中V2O5 发生反应的离子方程式为 ___________________________ 。
(2)②、③中的变化过程可简化为(下式中的R 表示 VO2+或 Fe3+,HA 表示有机萃取剂的主要成分)R2(SO4)n(水层)+2nHA(有机层) 2RA(有机层)+ nH2SO4(水层)。②中萃取时必须加入适量碱,其原因是 ______________________;实验室进行萃取操作使用的玻璃仪器为 ______________________。
(3)实验室用的原料中V2O5 占 6%(原料中的所有钒已换算成 V2O5)。取 100 g 该废钒催化剂按工业生产的步骤进行实验,当加入 100 mL 0.1 molL -1 的KClO3 溶液时,溶液中的钒恰好被完全处理,假设以后各步钒没有损失,则该实验中钒的回收率是 __________________[M(V2O5)=182 gmol -1]。
(4)25℃时,取样进行实验分析,得到钒沉淀率和溶液 pH 之间的关系如表所示:
pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 |
钒沉淀率/% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.6 | 96.4 | 93.1 |
试判断在实际生产时,⑤中加入 NH4Cl 调节溶液的最佳 pH为____________;若钒沉淀率为 93.1%时不产生 Fe(OH)3 沉淀,则此时溶液中 c(Fe3+)≤____________ (已知:25℃时Ksp[Fe(OH)3]=2.6×10 -39)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“中和滴定”原理在实际生产生活中应用广泛。用I2O5可定量测定CO的含量,该反应原理为5CO+I2O5![]() 5CO2+I2。其实验步骤如下:
5CO2+I2。其实验步骤如下:
①取250 mL(标准状况)含有CO的某气体样品,通过盛有足量I2O5的干燥管,在170 ℃下充分反应;
②用水-乙醇混合溶液充分溶解产物I2,配制100 mL溶液;
③量取步骤②中溶液25.00 mL于锥形瓶中,然后用0.01 mol·L-1的Na2S2O3标准溶液滴定。
(1)步骤②中配制100 mL待测溶液需要用到的玻璃仪器的名称是烧杯、量筒、玻璃棒、胶头滴管和____________________。
(2)Na2S2O3标准液应装在__________(填字母)中。

(3)指示剂应选用__________,判断达到滴定终点的现象是____________。(已知:气体样品中其他成分不与I2O5反应:2Na2S2O3+I2=2NaI+Na2S4O6)。
(4)下列操作会造成所测CO的体积分数偏大的是________(填字母)。
a.滴定终点俯视读数
b.锥形瓶用待测溶液润洗
c.滴定前有气泡,滴定后没有气泡
d.配制100 mL待测溶液时,有少量溅出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置能达到实验目的的是( )
|
|
|
|
A.测定一定时间内生成 H2的反应速率 | B.可以进行中和热的测定实验 | C.比较温度对化学反应速率的影响 | D.比较Cu2+、Fe3+对 H2O2分解速率的影响 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硅晶体是立体的网状结构,其结构如图所示.关于二氧化硅晶体的下列说法不正确的是( )
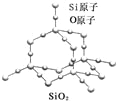
A. 晶体中Si、O原子个数比为1:2
B. 晶体中Si、O原子最外层都满足8电子结构
C. 晶体中一个硅原子含有Si﹣O键数目为4
D. 晶体中最小环上的原子数为6
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com