
| A、CO和CO2 |
| B、GeO和GeO2 |
| C、SnO和SnO 2 |
| D、PbO和PbO2 |


科目:高中化学 来源: 题型:
| A、用白醋除铁锈:Fe2O3?xH2O+6H+=(3+x)H2O+2Fe3+ |
| B、用强碱溶液吸收工业制取硝酸尾气:NO+NO2+2OH-=2NO3-+H2O |
| C、将少量SO2气体通入氨水中:SO2+NH3?H2O=NH4++HSO3- |
| D、向稀硫酸中加入少量Ba(OH)2溶液:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 离子方程式 | 评价 |
| A | 将2mol Cl2通入到含1mol FeI2的溶液中: 2Fe2++2I-+2Cl2═2Fe3++4Cl-+I2 | 正确; Cl2过量,Fe2+、I-均被氧化 |
| B | 用Cu电极电解NaCl溶液阳极的电极反应式: 2Cl--2e-═Cl2↑ | 正确; Cl-优先于OH-放电 |
| C | 过量SO2通入到NaClO溶液中: SO2+H2O+ClO-═HClO+HSO3- | 正确; H2SO3的酸性强于HClO |
| D | Mg(HCO3)2溶液与足量的NaOH溶液反应: Mg2++2HCO3-+4OH-═Mg(OH)2↓+2CO32-+2H2O | 正确; Mg(OH)2比MgCO3更难溶 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
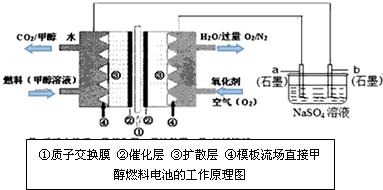
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、-283.01KJ/mol |
| B、+172.51 KJ/mol |
| C、+283.01KJ/mol |
| D、-504.01 KJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | A | B | C | D |
| 原子半径(nm) | 0.130 | 0.118 | 0.090 | 0.102 |
| 主要化合价 | +2 | +3 | +2 | +6,-2 |
| 元素 | E | F | G | H |
| 原子半径(nm) | 0.073 | 0.154 | 0.037 | 0.099 |
| 主要化合价 | -2 | +1 | +1 | +7,-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 4 |

查看答案和解析>>
科目:高中化学 来源: 题型:
- 3 |
| A、CaO、MgO |
| B、CaCO3、MgCO3 |
| C、CaCO3、Mg(OH)2 |
| D、CaCO3、MgO |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com