
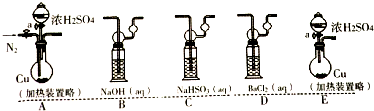
| 溶液 | ①品红溶液 | ②Na2S | ③BaCl2 | ④Ba(OH)2 | ⑤Ba(NO3)2 |
| 现象 | 溶液褪色 | 黄色沉淀 | 无明显现象 | 白色沉淀 | 白色沉淀 |
分析 (Ⅰ)(1)SO32-与S2-在酸性条件下反应生成S,向Na2S溶液中通入二氧化硫,通入一段时间后才渐渐产生黄色沉淀,说明二氧化硫的弱酸性和氧化性;
(Ⅱ)(2)铜表面先变黑后渐渐溶解,说明反应生成氧气,产生的气体通入使BaCl2溶液产生沉淀原因可能是亚硫酸根离子被氧气氧化生成硫酸钡,
(a)消除空气中的氧气影响,使空气通过亚硫酸氢钠溶液,氧气能够氧化亚硫酸氢钠而除去;
(b)浓硫酸分解生成二氧化硫和氧气;使混合气体通过亚硫酸氢钠溶液,氧气能够氧化亚硫酸氢钠而除去;
(3)Cu能够与稀硝酸反应生成氮的氧化物,结合信息:Cu2S不溶于稀硫酸,能够溶于热的稀硝酸中,且产生SO42-离子分析;
(4)从硫酸铜溶液中制取CuSO4•5H2O晶体,需要蒸发浓缩、冷却结晶、过滤洗涤、干燥称重.
解答 解:(Ⅰ)(1)Na2S溶液显碱性,在碱性环境中SO32-与S2-不反应,SO32-与S2-在酸性条件下反应生成S,向Na2S溶液中通入二氧化硫,通入一段时间后才渐渐产生黄色沉淀,说明二氧化硫具有氧化性和水溶液酸性,反应的离子方程式为2S2-+5SO2+2H2O=3S↓+4HSO3-,故答案为:氧化性;水溶液酸性;2S2-+5SO2+2H2O=3S↓+4HSO3-;
(Ⅱ)(2)产生的气体通入使BaCl2溶液产生沉淀是因为混合气体中含有氧气,氧气将亚硫酸根离子氧化为硫酸根离子,生成的沉淀为硫酸钡,
(a)空气首先通过C,再通过A,最后通入D,看有无沉淀,故答案为:CAD;
(b)Cu与浓硫酸反应时放热,温度升高导致浓硫酸分解生成二氧化硫和氧气,排除此因素,装置选择和连接顺序为ACD,故答案为:浓硫酸分解生成二氧化硫和氧气;ACD;
(3)A、Cu能够与稀硝酸反应生成氮的氧化物,滤出物中含有Cu,所以试管口有气体变浅棕色也不能证明有硫化亚铜,故A错误;
B、Cu2S和Cu都不溶于稀硫酸,而CuO能够溶于稀硫酸,所以取少量样品加入稀硫酸充分振荡,若观察溶液变蓝色,说明含有CuO,故B正确;
C、CuO和Cu与硝酸反应不能生成硫酸根离子,Cu2S能够溶于热的稀硝酸中,且产生SO42-离子,所以取少量样品加入足量稀硝酸加热溶解,若加入BaCl2检验有SO42-离子产生,证明有硫化亚铜,故C正确;
故答案为:BC;
(4)从硫酸铜溶液中制取CuSO4•5H2O晶体,需要蒸发浓缩、冷却结晶、过滤洗涤、干燥称重,故答案为:过滤洗涤.
点评 本题是实验探究题,题目难度大,思维含量大,注意联系物质的性质和题给信息.


科目:高中化学 来源: 题型:解答题
 .
. .
.
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
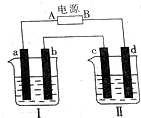 如图所示装置中,烧杯Ⅰ、Ⅱ中分别盛有200g 9.4%的Cu(NO3)2溶液和足量的饱和K2SO3溶液,所用电极均为惰性电极,请回答下列问题:
如图所示装置中,烧杯Ⅰ、Ⅱ中分别盛有200g 9.4%的Cu(NO3)2溶液和足量的饱和K2SO3溶液,所用电极均为惰性电极,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
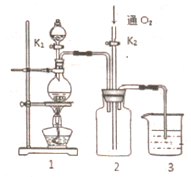 硫酸铜是一种应用极其广泛的化工原料,铜不能与稀硫酸直接反应,本实验中将适量浓硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体(装置如图1、2所示)
硫酸铜是一种应用极其广泛的化工原料,铜不能与稀硫酸直接反应,本实验中将适量浓硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体(装置如图1、2所示)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所得溶液中c(Ag+)•c(Cl-)>Ksp(AgCl) | |
| B. | 上述实验说明Cl-与NH4+间有很强的结合力 | |
| C. | 所得溶液中形成了难电离的物质 | |
| D. | 上述过程中NH3•H2O的电离常数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铍的氧化物对应的水化物可能具有两性 | |
| B. | 砹是一种有色固体,HAt很不稳定,AgAt是有色难溶于水的固体 | |
| C. | 高溴酸(HBrO4)的酸性比硒酸(H2SeO4)的酸性弱 | |
| D. | 硫酸锶(SrSO4)是难溶于水和盐酸的白色固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌粒与稀硫酸的反应 | |
| B. | 灼热的氧化铜与CO的反应 | |
| C. | 甲烷在空气中燃烧的反应 | |
| D. | Ba(OH)2•8H2O晶体与NH4Cl晶体的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 (1)拆开1mol H-H键,1mol N-H键,1mol N三N键分别需要吸收的能量为436kJ,391kJ,946kJ,则理论上,每生成1mol NH3放出(填:吸收或放出)热量46 kJ;
(1)拆开1mol H-H键,1mol N-H键,1mol N三N键分别需要吸收的能量为436kJ,391kJ,946kJ,则理论上,每生成1mol NH3放出(填:吸收或放出)热量46 kJ;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com