
【题目】实验室中,有关试剂的保存方法错误的是( )
A.少量白磷保存在水中B.少量金属钠保存在煤油中
C.烧碱溶液保存在带玻璃塞的试剂瓶中D.浓硝酸保存在棕色细口瓶中
科目:高中化学 来源: 题型:
【题目】下列装置或操作能达到目的的是
|
|
|
|
A. 只用装置①的仪器可以测定生成氢气的速率(mL/s)
B. 装置②可依据单位时间内颜色变化来比较浓度对反应速率的影响
C. 装置③进行中和反应反应热的测定实验
D. 装置④依据出现浑浊的快慢比较温度对反应速率的影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下说法正确的是( )
A.H2SO4在电流作用下在水中电离出H+ 和SO42
B.NaCl溶液能导电是因为溶液中有自由移动的Na+ 和Cl
C.由单质X变为X2-的反应是氧化反应
D.某元素处于最高价态时只具有还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质水溶液中存在电离平衡、水解平衡、溶解平衡,请回答下列问题。
(1)已知部分弱酸的电离常数如下表:
弱酸 | CH3COOH | HCN | H2CO3 |
电离常数(25℃) | Ka = 1.8×10-5 | Ka=4.3×l0-10 | Ka1=5.0×l0-7 Ka2=5.6×l0-11 |
① 0.1 moI/L NaCN溶液和0.1mol/L NaHCO3溶液中,c(CN-)______c(HCO3-)(填“>”、“<”或“=”)。
②常温下,pH相同的三种溶液:A.CH3COONa B.NaCN C.Na2CO3,其物质的量浓度由大到小的顺序是________(填编号)。
③已知25℃时,CH3COOH(aq)+OH-( aq)=CH3COO-(aq) +H2O △H=-akJ/mol,H+(aq) +OH-(aq) =H2O △H=-b kJ/mol,醋酸电离的热化学方程式为________________。
④将少量CO2通入NaCN溶液,反应的离子方程式是____________________________。
⑤室温下,-定浓度的CH3COONa溶液pH=9,用离子方程式表示溶液呈碱性的原因是______________,溶液中c(CH3COO-)/c(CH3COOH) =___________。
(2)室温下,用0.100 mol/L盐酸溶液滴定20.00mL0.l00mol/L 的某氨水溶液,滴定曲线如图所示(横坐标为盐酸的体积)。
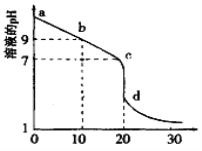
① d点所示的溶液中离子浓度由大到小的顺序依次为____________。
② b点所示的溶液中c(NH3·H2O)-c(NH4+)=_________(用溶液中的其它离子浓度表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气燃烧生成液态水的热化学方程式是2H2(g)+O2(g)===2H2O(1) ΔH=-572 kJ·mol-1。请回答下列问题:
(1)生成物能量总和________(填“大于”“小于”或“等于”)反应物能量总和。
(2)若2 mol氢气燃烧生成水蒸气,则放出的热量________(填“大于”“小于”或“等于”)572 kJ。
(3)H2的标准燃烧热ΔH=________。
(4)反应2H2+O2![]() 2H2O的能量变化如图所示。已知拆开1 mol H2、1 molO2和1 mol H—O中的化学键分别需要消耗436 kJ、496 kJ和463 kJ的能量。则反应过程(Ⅱ)________(填“吸收”或“放出”)________kJ。
2H2O的能量变化如图所示。已知拆开1 mol H2、1 molO2和1 mol H—O中的化学键分别需要消耗436 kJ、496 kJ和463 kJ的能量。则反应过程(Ⅱ)________(填“吸收”或“放出”)________kJ。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温条件下,可逆反应:2NO(g)+O2(g)![]() 2NO2(g)在体积固定的密闭容器中进行,达到平衡状态的标志的是( )
2NO2(g)在体积固定的密闭容器中进行,达到平衡状态的标志的是( )
①单位时间内生成n mol O2的同时生成2n mol NO2②单位时间内生成n mol O2的同时生成2n mol NO③用NO2、NO、O2表示的反应速率的比为2:2:1的状态④混合气体的颜色不再改变的状态⑤混合气体的密度不再改变的状态⑥混合气体的压强不再改变的状态⑦混合气体的平均相对分子质量不再改变的状态.
A. ①④⑥⑦ B. ②③⑤⑦ C. ①③④⑤ D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E、F都是短周期的元素,它们的原子序数依次递增。A原子的电子层数与它的核外电子总数相同,而B原子的最外层电子数是次外层的2倍,C的氢化物可使湿润的红色石蕊试纸变蓝,B和D可以形成两种气态化合物,E原子核外电子总数比B的2倍少1,F在本周期元素中原子半径最小。则:
(1)A、B、C、D、E、F的名称分别是 _____________________________ 。
(2)在A至F中任选元素,写出一种含非极性键的离子化合物的电子式 _________ 。
(3)由B和D组成,且B和D的质量比为3∶8的化合物的电子式是 _________ ,该物质与E的同周期相邻主族元素的单质反应的化学方程式为__________________ 。
(4)F单质与E的最高价氧化物的水化物反应的化学方程式为_________________________。
(5)将8g BA4完全燃烧后恢复到室温,放出热量a kJ,写出表示BA4的燃烧热的热化学方程式_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.195g锌粉加入到20.0mL的0.100mol/L的MO2+溶液中,恰好完全反应,则还原产物可能是
A. M2+ B. M C. MO2+ D. M3+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com