
| A. | 溶液中至少有4种离子存在,其中Cl-一定存在,且c(Cl-)≥0.2 mol•L-1 | |
| B. | 原溶液中c(Fe3+)=0.2 mol•L-1 | |
| C. | SO42-、NH4+、Na+一定存在,CO32-、Al3+一定不存在 | |
| D. | 取少量原溶液并加入KSCN溶液,呈血红色,说明该溶液一定没有Fe2+,只有Fe3+ |
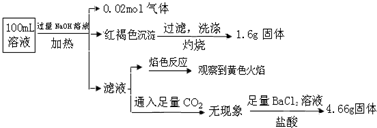
分析 加入过量NaOH溶液,加热,得到0.02mol气体,该气体为氨气,原溶液中一定存在0.02molNH4+;
产生的红褐色沉淀为氢氧化铁,1.6g固体为三氧化二铁,氧化铁的物质的量为0.01mol,则原溶液中含有0.02mol铁元素,可能为Fe3+、Fe2+,原溶液中一定没有CO32-;
滤液通入二氧化碳无现象,则原溶液中一定不存在Al3+;
4.66g不溶于盐酸的固体为硫酸钡,硫酸钡的物质的量为0.02mol,原溶液中含有0.02mol硫酸根离子;
颜色反应为黄色,则溶液中存在钠离子,由于加入了氢氧化钠溶液,无法判断原溶液中是否含有钠离子,由溶液为电中性可判断是否存在氯离子,以此来解答.
解答 解:加入过量NaOH溶液,加热,得到0.02mol气体,该气体为氨气,原溶液中一定存在0.02molNH4+;
产生的红褐色沉淀为氢氧化铁,1.6g固体为三氧化二铁,氧化铁的物质的量为0.01mol,则原溶液中含有0.02mol铁元素,可能为Fe3+、Fe2+,原溶液中一定没有CO32-;
滤液通入二氧化碳无现象,则原溶液中一定不存在Al3+;
颜色反应为黄色,则溶液中一定存在钠离子,由于加入了NaOH,无法判断原溶液中是否含有Na+;
4.66g不溶于盐酸的固体为硫酸钡,硫酸钡的物质的量为0.02mol,则原溶液中含有0.02mol硫酸根离子,
由电荷守恒,原溶液中一定有Cl-,物质的量至少为 0.02mol×2+0.02mol-0.02mol×2=0.02mol,
A.由以上分析,原溶液中一定存在0.02molNH4+,0.02molSO42-,0.02molFe3+、Fe2+中的一种,当铁元素全部为亚铁离子时,阳离子所带电荷的物质的量最小,所以正电荷物质的量最少为0.02mol×2+0.02mol=0.06mol,而负电荷的物质的量为0.02mol×2=0.04mol,根据溶液电中性可知,原溶液中一定存在Cl-,且c(Cl-)≥$\frac{0.06mol-0.04mol}{0.1L}$=0.2 mol•L-1,故A正确;
B.原溶液中含有0.02molFe,无法判断存在的是铁离子或者亚铁离子,故B错误;
C.原溶液中一定存在SO42-、NH4+、Cl-,只是存在Fe3+、Fe2+中的一种,其离子的物质的量为0.02mol,一定不存在CO32-、Al3+;由于第一步中加入了氢氧化钠溶液,引进了钠离子,无法确定原溶液中是否含有钠离子,故C错误;
D.少量原溶液并加入KSCN溶液,呈血红色,可知一定含Fe3+,不能确定是否含Fe2+,故D错误;
故选A.
点评 本题考查溶液中成分的确定,为高频考点,注意掌握常见离子的性质及检验方法为解答的关键,注意根据溶液电中性判断氯离子存在,侧重分析、推断能力的综合考查,题目难度中等.


 优生乐园系列答案
优生乐园系列答案科目:高中化学 来源: 题型:选择题
| A. | 水电离的c(H+):①=②=③=④ | |
| B. | 将②、③溶液混合后,pH=7,消耗溶液的体积:②<③ | |
| C. | 等体积的①、②、④溶液分别与足量铝粉反应,生成H2的量:④最大 | |
| D. | 向溶液中加入100 mL水后,溶液的pH:③>④>①>② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=14的溶液中:K+、Ca2+、HCO${\;}_{3}^{-}$、SO${\;}_{4}^{2-}$ | |
| B. | 常温下,$\frac{c(O{H}^{-})}{c({H}^{+})}$=10-10的溶液中:Na+、NH4+、SO42-、NO3- | |
| C. | c(ClO-)=1.0mol•L-1的溶液中:Na+、SO32-、S2-、SO42- | |
| D. | 0.1 mol•L-1的NaAlO2溶液中:NH4+、Fe3+、Cl-、I- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | ② | B. | ②③ | C. | ②③④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
组别 | 甲 | 乙 | 丙 |
| A | NO | NH3 | H2O |
| B | CO2 | Na2CO3 | Ba(OH)2 |
| C | Al | Fe2O3 | HCl |
| D | Cl2 | FeCl2 | Ca(OH)2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤的干馏和煤的液化均是物理变化 | |
| B. | 活性炭使糖浆脱色与次氯酸盐漂白纸浆的原理相同 | |
| C. | 海水淡化的方法有蒸馏法、电渗析法等 | |
| D. | 新型能源生物柴油和矿物油主要化学成分相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C4H8 | B. | C2H6O | C. | C3H6O | D. | C2H4O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
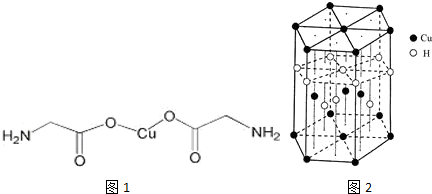
 ,与Cu同周期的元素中,与铜原子最外层电子数相等的元素还有K Cr(填元素符号),上述方程式中涉及到的N、O元素第一电离能由小到大的顺序为O<N.
,与Cu同周期的元素中,与铜原子最外层电子数相等的元素还有K Cr(填元素符号),上述方程式中涉及到的N、O元素第一电离能由小到大的顺序为O<N.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com