
| A. | Cl2 | B. | H+ | C. | Cl- | D. | H2 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:推断题
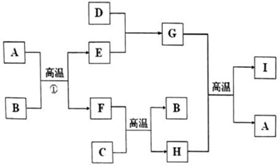 有关物质的转化关系如图所示(部分物质与条件己略去).A是最常见的无色液体,B、C是常见的金属单质,D、E是气体单质,且D在空气中的含量最多,F 是一种具有磁性的化合物,H是既能与强酸反应又能与强碱反应的氧化物:I具有耐高温、抗冲击、导热性好的优良性质,广泛应用于电子工业、陶瓷工业中.
有关物质的转化关系如图所示(部分物质与条件己略去).A是最常见的无色液体,B、C是常见的金属单质,D、E是气体单质,且D在空气中的含量最多,F 是一种具有磁性的化合物,H是既能与强酸反应又能与强碱反应的氧化物:I具有耐高温、抗冲击、导热性好的优良性质,广泛应用于电子工业、陶瓷工业中. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油的裂解、煤的干馏、蛋白质的盐析都是化学变化 | |
| B. | C2H4Cl2、C5H12均只有两种同分异构体 | |
| C. | Na与H2O的反应是熵增的放热反应,该反应能自发进行 | |
| D. | 已知25℃、101kPa,在稀溶液中:H+ (aq)+OH-(aq)=H2O(aq)△H=-57.3kJ/mol.则相同条件下,若将含1molCH3COOH的稀溶液与含1molNaOH的稀溶液混合,放出的热量等于57.3kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 弱酸 | 电离常数 | 弱酸 | 电离常数 |
| H2CO3 | Ka1=4.4×10-7 | H2C2O4 | Ka1=5.4×10-2 |
| Ka2=4.7×10-11 | Ka2=5.4×10-5 |
| A. | 2 | B. | 4 | C. | 6 | D. | 8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | Cl2(HCl) | NaOH溶液 |
| B | Fe2O3(Al2O3) | NaOH溶液 |
| C | Na2CO3溶液(NaCl) | AgNO3溶液 |
| D | Na2SO4溶液(Na2CO3) | 稀盐酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为了使反应进行的更完全,可以使酸或碱适当过量 | |
| B. | 为了使反应均匀进行,可以向酸(碱)中分次加入碱(酸) | |
| C. | 因为中和热为一定值,所以实验结果与所用酸(碱)的用量 和种类均无关 | |
| D. | 测酸溶液的温度后,未冲洗温度计就直接测碱溶液的温度,会使中和热的数值偏大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素X与Z同主族 | |
| B. | 原子半径:r(W)>r(X)>r(Y)>r(Z) | |
| C. | 由元素X,Y,Z形成的常见化合物为共价化合物 | |
| D. | 最简单气态氢化物的稳定性由强到弱的顺序:Y、X、W |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com