
| ||
| A、(Ⅰ)中会生成BaSO3、BaSO4两种沉淀 |
| B、可将(Ⅰ)中的BaCl2溶液改为Ba(NO3)2溶液 |
| C、(Ⅱ)所盛X应为品红溶液 |
| D、(Ⅲ)的作用是检验生成的SO2气体 |


科目:高中化学 来源: 题型:

| 时间t/min | 0 | 1 | 2 | 3 | 4 | 5 |
| 总压强p 100kPa | 5 | 5.6 | 6.4 | 6.8 | 7 | 7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、t1 |
| B、t2 |
| C、t3 |
| D、t4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2g | B、4g | C、8g | D、10g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属钠保存在四氯化碳里 |
| B、碳酸钠晶体露置在空气里 |
| C、液溴存放在盛有一些水的试剂瓶里 |
| D、新制氯水存放在无色透明的试剂瓶里,并置于明亮处 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、浓度越大,消耗的硝酸越少 |
| B、硝酸浓度不同,生成的Cu(NO3)2的物质的量不同 |
| C、硝酸浓度越大,产生的气体越少 |
| D、两者用排水法收集的气体体积相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、20% | B、80% |
| C、15.8% | D、84.2% |
查看答案和解析>>
科目:高中化学 来源: 题型:
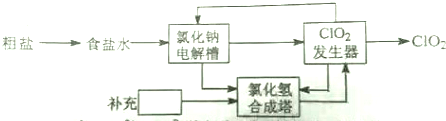
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com