
【题目】间苯二酚大环内酯具有较强的抗癌活性,其结构简式如图。下列有关间苯二酚大环内酯的说法不正确的是( )

A.能使酸性KMnO4溶液褪色
B.能与FeCl3溶液发生显色反应
C.能与浓溴水发生加成反应和取代反应
D.属于油脂类化合物
科目:高中化学 来源: 题型:
【题目】在等温等容条件下,有下列气体反应:2A(g)+2B(g)![]() C(g)+3D(g)。现分别从两条途径建立平衡:Ⅰ:A、B的起始浓度均为2mol/L。Ⅱ:C、D的起始浓度分别为2mol/L和6mol/L。下列叙述正确的是( )
C(g)+3D(g)。现分别从两条途径建立平衡:Ⅰ:A、B的起始浓度均为2mol/L。Ⅱ:C、D的起始浓度分别为2mol/L和6mol/L。下列叙述正确的是( )
A.Ⅰ和Ⅱ两途径最终达到平衡时,系统内混合气体的平均相对分子质量不同
B.Ⅰ和Ⅱ两途径最终达到平衡时,系统内混合气体的百分组成不同
C.达到平衡时Ⅰ途径的VA等于Ⅱ途径的VA
D.达到平衡后,第Ⅰ途径混合气密度为第Ⅱ途径混合气密度的![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究实验室制乙烯及乙烯和溴水的加成反应。甲同学设计了如图所示的实验装置,并进行了实验。当温度升至170℃左右时,有大量气体产生,产生的气体通入溴水中,溴水的颜色迅速褪去。甲同学认为达到了实验目的。
乙同学仔细考察了甲同学的整个实验过程,发现当温度升到100℃左 右时,无色液体开始变色,到160℃左右时,混合液全呈黑色,在170℃超过后生成气体速度明显加快,生成的气体有刺激性气味。由此他推出,产生的气体中应有杂质,可能影响乙烯的检出,必须除去。据此回答下列问题:
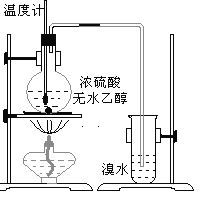
(1)写出甲同学实验中两个反应的化学方程式:_____________、___________________________。
(2)乙同学观察到的黑色物质是_____________,刺激性气体是_____________。乙同学认为刺激性气体的存在就不能认为溴水褪色是乙烯的加成反应造成的。原因是(用化学方程表示):________。
(3)丙同学根据甲乙同学的分析,认为还可能有CO、CO2两种气体产生。为证明CO存在,他设计了如下过程(该过程可把实验中产生的有机产物除净):发现最后气体经点燃是蓝色火焰,确认有一氧化碳。
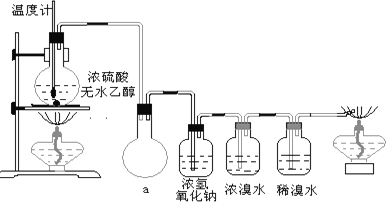
①设计装置a的作用是____________________
②浓溴水的作用是_______________________,稀溴水的作用是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.1 mol![]() 中含有的碳碳双键数为4NA
中含有的碳碳双键数为4NA
B.1 L 0.1mol/L NH4Cl溶液中含有NH![]() 的数目为0.1NA
的数目为0.1NA
C.6.2g白磷分子中含P-P键为0.2 NA
D.7.8gNa2O2和Na2S的固体混合物中含有的离子总数为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,将PCl3(g)和Cl2(g)充入体积不变的2L密闭容器中发生下述反应:
PCl3(g)+ Cl2(g) PCl5(g);5min末达到平衡,有关数据如右表。
PCl3(g) | Cl2(g) | PCl5(g) | |
初始浓度(molL—1) | 2.0 | 1.0 | 0 |
平衡浓度(molL—1) | C1 | C2 | 0.4 |
下列判断不正确的是
A.若升高温度,反应的平衡常数减小,则正反应为吸热
B.反应5min内,v(PCl3)="0.08" molL-1min-1
C.当容器中为1.2mol时,可逆反应达到平衡状态
D.平衡后移走2.0mol PCl3和1.0mol Cl2,在相同条件下再达平衡时,c(PCl5)<0.2 molL—1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究某化合物X (含两种短周期元素,相同条件下,X的相对分子质量是氢气的83.5倍)的组成和性质,某化学兴趣小组设计了如下实验,同温同压下测得A的体积是B的二倍,其中气体B、C为单质。.
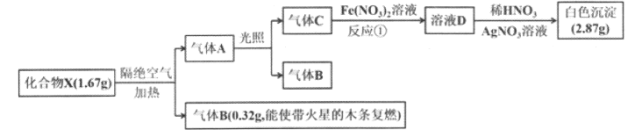
请回答下列问题:
(1)化合物X的化学式为______, 气体C的电子式为________
(2)化合物X隔绝空气受热分解的化学方程式为________。
(3)实验室常用湿润的KI淀粉试纸检验气体C,写出离子方程式_________ , 现象__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机反应类型中,不正确的是
A.![]() +HNO3
+HNO3![]() +H2O取代反应
+H2O取代反应
B.CH3CH3+Cl2![]() CH3CH2Cl+HCl置换反应
CH3CH2Cl+HCl置换反应
C.CH2=CH2+H2O![]() CH3CH2OH加成反应
CH3CH2OH加成反应
D.2CH3CHO+O2![]() 2CH3COOH氧化反应
2CH3COOH氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是某学生为探究AgCl沉淀转化为![]() 沉淀的反应所做实验的记录.
沉淀的反应所做实验的记录.
步骤 | 现象 |
Ⅰ | 立即产生白色沉淀 |
Ⅱ | 沉淀迅速变为黑色 |
Ⅲ | 较长时间后,沉淀变为乳白色 |
Ⅳ | 产生红棕色气体,沉淀部分溶解 |
Ⅴ | 产生白色沉淀 |
![]() 为了证明沉淀变黑是AgCl转化为
为了证明沉淀变黑是AgCl转化为![]() 的缘故,步骤I中NaCl溶液的体积范围为 ______ 。
的缘故,步骤I中NaCl溶液的体积范围为 ______ 。
![]() 已知:
已知:![]() 时
时![]() ,
,![]() ,此沉淀转化反应的平衡常数
,此沉淀转化反应的平衡常数![]() ______。
______。
![]() 步骤V中产生的白色沉淀的化学式为 ______ ,步骤Ⅲ中乳白色沉淀除含有AgCl外,还含有 ______。
步骤V中产生的白色沉淀的化学式为 ______ ,步骤Ⅲ中乳白色沉淀除含有AgCl外,还含有 ______。
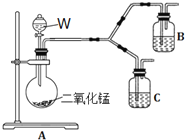
![]() 为了进一步确认步骤Ⅲ中乳白色沉淀产生的原因,设计了如下图所示的对比实验装置。
为了进一步确认步骤Ⅲ中乳白色沉淀产生的原因,设计了如下图所示的对比实验装置。
![]() 装置A中玻璃仪器有圆底烧瓶、导管和 ______ ,试剂W为 ______ 。
装置A中玻璃仪器有圆底烧瓶、导管和 ______ ,试剂W为 ______ 。
![]() 装置C中的试剂为NaCl溶液和
装置C中的试剂为NaCl溶液和![]() 悬浊液的混合物,B中试剂为 ______ 。
悬浊液的混合物,B中试剂为 ______ 。
![]() 实验表明:C中沉淀逐渐变为乳白色,B中没有明显变化。
实验表明:C中沉淀逐渐变为乳白色,B中没有明显变化。
完成C中反应的化学方程式:______Ag2S+_____NaCl+______ + ______ AgCl+S+ ______
______
C中NaCl的作用是: ______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】小明在研究元素时发现,可以将前18号元素排成如图所示的“蜗牛”形状,图中每个“·”代表一种元素,其中O点代表氢元素。下列说法中错误的是
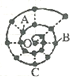
A. 虚线相连的元素处于同一族,A元素位于元素周期表ⅥA族
B. 离O点越远的元素原子半径一定越大
C. B、C最高价氧化物的水化物可以相互反应
D. B元素是图中金属性最强的元素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com