
| A、1 mol Cu与足量稀HNO3反应,转移3nA个电子 |
| B、常温常压下,22.4LCl2含有2nA个Cl原子 |
| C、16gCH4含有10nA个电子 |
| D、1LO.1 mol.L-1Na2SO3溶液中含有O.1nA个S032- |
| m |
| M |
| m |
| M |
| 16g |
| 16g/mol |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| ||
| 含锌废水水质 | 国家环保标准值 | |
| Zn2+浓度/(mg.L-1) | ≤800 | ≤3.9 |
| pH | 1~5 | 6~ |
查看答案和解析>>
科目:高中化学 来源: 题型:
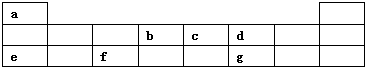
查看答案和解析>>
科目:高中化学 来源: 题型:
 某补钙剂说明书的部分信息如图所示.小明对该补钙剂十分感兴趣,取10片钙片放入100g稀盐酸中,有效成分刚好完全反应(其他成分不与盐酸反应).剩余固体和液体总质量比反应前减少了2.2g.请完成下列问题:
某补钙剂说明书的部分信息如图所示.小明对该补钙剂十分感兴趣,取10片钙片放入100g稀盐酸中,有效成分刚好完全反应(其他成分不与盐酸反应).剩余固体和液体总质量比反应前减少了2.2g.请完成下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
A、8个中子的碳原子的核素符号:
| ||
B、H2O的电子式: | ||
C、Cl-的结构示意图: | ||
D、CH4分子的比例模型: |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1L 1mol?L-1的NaClO溶液中含有ClO-的数目为NA |
| B、78g苯含有C=C键的数目为3NA |
| C、常温常压下18gH218O含有原子总数为3NA. |
| D、标准状况下,2.24LCO2与足量的Na2O2充分反应,转移电子总数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
 以下表及图中分别表示物质间的从属关系,其中不正确的是( )
以下表及图中分别表示物质间的从属关系,其中不正确的是( )| X | Y | Z | H | |
| A | 分散系 | 胶体 | 溶液 | 烟 |
| B | 电解质 | 酸 | 碱 | 含氧酸 |
| C | 氧化物 | 酸性氧化物 | 碱性氧化物 | 非金属氧化物 |
| D | 元素周期表的纵列 | 主族 | 副族 | 卤族 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| 元素代号 | I1 | I2 | I3 | I4 |
| Q | 2080 | 4000 | 6100 | 9400 |
| R | 500 | 4600 | 6900 | 9500 |
| S | 740 | 1500 | 7700 | 10500 |
| T | 580 | 1800 | 2700 | 11600 |
| U | 420 | 3100 | 4400 | 5900 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 常用于制备药物和合成高分子材料.(1)化合物Ⅰ的分子式为
常用于制备药物和合成高分子材料.(1)化合物Ⅰ的分子式为
 +CH3COOH→
+CH3COOH→ .聚合物可用于制备
.聚合物可用于制备
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com