
| A. | 乙酸溶液中存在乙酸分子,能证明乙酸是一种弱酸 | |
| B. | 丙醛和乙醛都有醛基,都能和银氨溶液、新制氢氧化铜反应 | |
| C. | 除去工业乙醇中少量水常加入生石灰,并蒸馏 | |
| D. | 油脂、淀粉、蛋白质、纤维素属于天然高分子化合物 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 若反应是放热反应,升高温度,正反应速率增大 | |
| B. | 往容器中通入稀有气体He,由于压强增大,所以反应速率增大 | |
| C. | 往容器中加入少量A,反应速率增大 | |
| D. | 当容器内的压强不再变化,可以判断反应已经达到平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
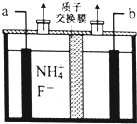 (1)某催化剂可将汽车尾气中的CO、NO转化为无毒气体.已知:
(1)某催化剂可将汽车尾气中的CO、NO转化为无毒气体.已知:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
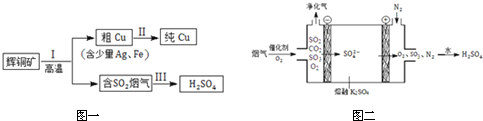
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子的原子序数越大,原子半径越大 | |
| B. | 同族元素相差的原子序数可能为16、26、36、46 | |
| C. | I A族与ⅦA族元素间可形成共价化合物或离子化合物 | |
| D. | 碱金属单质的熔点、沸点均随着原子序数的递增而升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
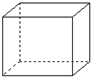 有机物的结构可用“键线式”简化表示.例如CH3-CH=CH-CH3可简写为
有机物的结构可用“键线式”简化表示.例如CH3-CH=CH-CH3可简写为  .“立方烷”是一种新合成的烃,其分子为正方体结构,其碳架结构如图:
.“立方烷”是一种新合成的烃,其分子为正方体结构,其碳架结构如图: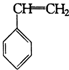 B.
B. 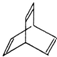 C.
C.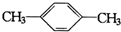 D.
D.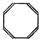
 +Br2→
+Br2→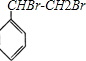 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com