
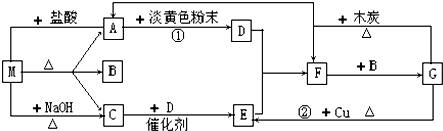


科目:高中化学 来源: 题型:
| A、该有机物中含C、H、O三种原子 |
| B、该化合物是乙烷 |
| C、该化合物中C、H原子个数比为1:3 |
| D、该化合物分子中含2个C原子、6个H原子,但一定不含有O原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 金属 | Na | Al | Cu | Fe |
| 熔点(℃) | 97.81 | 660 | 1083 | 1535 |
| 沸点(℃) | 883 | 2200 | 2595 | 3000 |
| A、Fe-Cu合金 |
| B、Cu-Al合金 |
| C、Al-Na合金 |
| D、Cu-Na合金 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
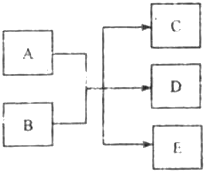 在一定条件下,物质A~E相互转化的关系下图所示,其中A为单质,常温下E是无色液体.请根据条件回答下列问题(填写化学用语):
在一定条件下,物质A~E相互转化的关系下图所示,其中A为单质,常温下E是无色液体.请根据条件回答下列问题(填写化学用语):查看答案和解析>>
科目:高中化学 来源: 题型:
| 需加入的试剂 | 分离装置 | |
| 苯(乙醇) | ||
| 乙烷(乙烯) | ||
| 乙醇(乙酸) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| T/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、所有主族元素的正化合价数,等于它的族序数 |
| B、第ⅦA族元素的原子随核电荷数的增加,得电子能力逐渐减弱 |
| C、第ⅡA族元素的阳离子与同周期稀有气体元素的原子具有相同的核外电子排布 |
| D、前三周期元素中共有非金属元素12种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com