
”¾ĢāÄæ”æX”¢Y”¢Z”¢U”¢WŹĒŌ×ÓŠņŹżŅĄ“ĪŌö“óµÄĒ°ĖÄÖÜĘŚŌŖĖŲ”£ĘäÖŠYµÄŌ×ÓŗĖĶāÓŠ7ÖÖŌĖ¶ÆדĢ¬²»Ķ¬µÄµē×Ó£»X”¢ZÖŠĪ“³É¶Ōµē×ÓŹż¾łĪŖ2£»UŹĒµŚČżÖÜĘŚŌŖĖ÷ŠĪ³ÉµÄ¼ņµ„Ąė×ÓÖŠ°ė¾¶×īŠ”µÄŌŖĖŲ£»WµÄÄŚ²ćµē×ÓČ«³äĀś£¬×īĶā²ćÖ»ÓŠ1øöµē×Ó”£Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©X”¢Y”¢ZµÄµŚŅ»µēĄėÄܓӓ󵽊”µÄĖ³ŠņŹĒ_____________ (ÓĆŌŖĖŲ·ūŗűķŹ¾£¬ĻĀĶ¬)”£
£Ø2£©Š“³öWµÄ¼Ūµē×ÓÅŲ¼Ź½__________________________£¬WĶ¬ÖÜĘŚµÄŌŖĖŲÖŠ£¬ÓėWŌ×Ó×īĶā²ćµē×ÓŹżĻąµČµÄŌŖĖŲ»¹ÓŠ_____________”£
£Ø3£©X”¢Y”¢ZµÄ¼ņµ„Ēā»ÆĪļµÄ¼ü½Ē“ӓ󵽊”µÄĖ³ŠņŹĒ__________________________(ÓĆ»ÆѧŹ½±ķŹ¾)£¬ŌŅņŹĒ__________________________”£
£Ø4£©ÓÉŌŖĖŲYÓėUŌŖĖŲ×é³ÉµÄ»ÆŗĻĪļA£¬¾§°ū½į¹¹ČēĶ¼ĖłŹ¾£ØŗŚĒņ±ķŹ¾YŌ×Ó£¬°×Ēņ±ķŹ¾UŌ×Ó£©£¬ĒėŠ“³ö»ÆŗĻĪļAµÄ»ÆѧŹ½_____________£¬øĆĪļÖŹÓ²¶Č“ó£¬ĶĘ²āøĆĪļÖŹĪŖ_____________¾§Ģ唣ĘäÖŠYŌŖĖŲµÄŌӻƷ½Ź½ŹĒ_____________”£

”¾“š°ø”æ N>O>C 3d104s1 K”¢Cr CH4>NH3>H2O 3ÖÖĒā»ÆĪļµÄÖŠŠÄŌ×Ó¼Ū²ćµē×Ó¶ŌŹż¾łĪŖ4£¬¾łĪŖÕżĖÄĆęĢå½į¹¹£¬µ«ÖŠŠÄŌ×ӵĹĀµē×Ó¶ŌŹżŅĄ“ĪŌö¼Ó£¬µ¼ÖĀ¼ü½Ē±äŠ” AlN Ō×Ó sp3
”¾½āĪö”æX”¢Y”¢Z”¢U”¢WŹĒŌ×ÓŠņŹżŅĄ“ĪŌö“óµÄĒ°ĖÄÖÜĘŚŌŖĖŲ”£ĘäÖŠYµÄŌ×ÓŗĖĶāÓŠ7ÖÖŌĖ¶ÆדĢ¬²»Ķ¬µÄµē×Ó£¬ŌņYĪŖNŌŖĖŲ£ØŌŚ¶ąµē×ÓµÄŌ×ÓÖŠ£¬ČĪŗĪŅ»øöµē×ÓµÄŌĖ¶ÆדĢ¬¶¼ÓėĘäĖūµē×Ó²»Ķ¬£©£»X”¢ZÖŠĪ“³É¶Ōµē×ÓŹż¾łĪŖ2£¬ŌņX”¢Z·Ö±šĪŖCŌŖĖŲŗĶOŌŖĖŲ£»UŹĒµŚČżÖÜĘŚŌŖĖ÷ŠĪ³ÉµÄ¼ņµ„Ąė×ÓÖŠ°ė¾¶×īŠ”µÄŌŖĖŲ£¬ŌņUĪŖAlŌŖĖŲ£»WµÄÄŚ²ćµē×ÓČ«³äĀś£¬×īĶā²ćÖ»ÓŠ1øöµē×Ó£¬ŌņWĪŖCuŌŖĖŲ”£
£Ø1£©X”¢Y”¢ZµÄµŚŅ»µēĄėÄܓӓ󵽊”µÄĖ³ŠņŹĒN>O>C”£
£Ø2£©CuµÄ¼Ūµē×ÓÅŲ¼Ź½ĪŖ3d104s1£¬WĶ¬ÖÜĘŚµÄŌŖĖŲÖŠ£¬ÓėWŌ×Ó×īĶā²ćµē×ÓŹżĻąµČµÄŌŖĖŲ»¹ÓŠKŗĶCr ”£
£Ø3£©X”¢Y”¢ZµÄ¼ņµ„Ēā»ÆĪļµÄ¼ü½Ē“ӓ󵽊”µÄĖ³ŠņŹĒCH4>NH3>H2O£¬ŌŅņŹĒ3ÖÖĒā»ÆĪļµÄÖŠŠÄŌ×Ó¼Ū²ćµē×Ó¶ŌŹż¾łĪŖ4£¬Ęä¼Ū²ćµē×Ó¶Ō»„³āÄ£ŠĶ¶¼ŹĒÕżĖÄĆęĢå½į¹¹£¬µ«ÖŠŠÄŌ×ӵĹĀµē×Ó¶ŌŹżŅĄ“ĪŌö¼Ó£¬µ¼ÖĀ¼ü½Ē±äŠ””£
£Ø4£©ÓÉŌŖĖŲNÓėAlŌŖĖŲ×é³ÉµÄ»ÆŗĻĪļAlNµÄ¾§°ū½į¹¹Ź¾ŅāĶ¼æÉÖŖ£¬øĆ¾§°ūÖŠNŌ×ÓŗĶAlŌ×Ó¶¼ÓŠ4øö£¬ĖłŅŌ»ÆŗĻĪļAµÄ»ÆѧŹ½ĪŖAlN”£øĆĪļÖŹÓ²¶Č“ó£¬ĶĘ²āøĆĪļÖŹĪŖŌ×Ó¾§Ģ唣ŅņĪŖĆæøöNŌ×ÓŠĪ³É4øö¦Ņ¼ü£¬øł¾Ż¼Ū²ćµē×Ó¶Ō»„³āĄķĀŪæÉŅŌÅŠ¶Ļ³öNŌ×ÓµÄŌӻƷ½Ź½ŹĒsp3ŌӻƔ£


 ĢģĢģĻņÉĻŅ»±¾ŗĆ¾ķĻµĮŠ“š°ø
ĢģĢģĻņÉĻŅ»±¾ŗĆ¾ķĻµĮŠ“š°ø Š”ѧɜ10·ÖÖÓÓ¦ÓĆĢāĻµĮŠ“š°ø
Š”ѧɜ10·ÖÖÓÓ¦ÓĆĢāĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÖŠ¹śæĘѧ¼¼ŹõĆū“ŹÉó¶ØĪÆŌ±»įŅŃČ·¶ØµŚ116ŗÅŌŖĖŲLvµÄĆū³ĘĪŖćW”£¹ŲÓŚ![]() µÄŠšŹö“ķĪóµÄŹĒ
µÄŠšŹö“ķĪóµÄŹĒ
A. Ō×ÓŠņŹż116 B. ÖŠ×ÓŹż177
C. ŗĖĶāµē×ÓŹż116 D. Ļą¶ŌŌ×ÓÖŹĮæ293
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅ»¶ØĪĀ¶ČĻĀ£¬½«2molSO2ŗĶ1molO2³äČė2LĆܱÕČŻĘ÷ÖŠ£¬ŌŚ“߻ƼĮ“ęŌŚĻĀ½ųŠŠĻĀĮŠ·“Ó¦:2SO2(g)+O2(g)![]() 2SO3(g) ”÷H=-197kJ/mo!£¬ĻĀĮŠĖµ·ØÖŠÕżČ·µÄŹĒ
2SO3(g) ”÷H=-197kJ/mo!£¬ĻĀĮŠĖµ·ØÖŠÕżČ·µÄŹĒ
A. ·“Ó¦“ļµ½Ę½ŗāדĢ¬Ź±£¬»į·Å³ö197kJµÄČČĮæ
B. Ōö“óO2ÅضČæÉŅŌŹ¹SO2×Ŗ»ÆĀŹ“ļµ½100%
C. Ź¹ÓĆŗĻŹŹµÄ“߻ƼĮ”¢ÉżøßĪĀ¶Č¾łæɼӓó·“Ó¦ĖŁĀŹ
D. ·“Ó¦“ļµ½Ę½ŗāŹ±£¬Õż·“Ó¦ŗĶÄę·“Ó¦µÄ»Æѧ·“Ó¦ĖŁĀŹĻąµČĒŅ²»ĪŖĮć
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅŃÖŖ1gĒāĘųĶźČ«Č¼ÉÕÉś³ÉĖ®ÕōĘųŹ±·Å³öČČĮæ121kJ£¬ĒŅŃõĘųÖŠ1mol O=O¼üĶźČ«¶ĻĮŃŹ±ĪüŹÕČČĮæ496kJ£¬Ė®ÕōĘųÖŠ1mol H©O¼üŠĪ³ÉŹ±·Å³öČČĮæ463kJ£¬ŌņĒāĘųÖŠ1mol H©H¼ü¶ĻĮŃŹ±ĪüŹÕČČĮæĪŖ£Ø £©
A.920kJ
B.557kJ
C.436kJ
D.181kJ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æijĶ¬Ń§ŌŚŹµŃé±ØøęÖŠÓŠŅŌĻĀŹµŃ鏿¾Ż¼ĒĀ¼£¬ĘäÖŠŗĻĄķµÄŹĒ£Ø””””£©
A.ÓĆĶŠÅĢĢģĘ½³ĘČ”11.72gŹ³ŃĪ
B.ÓĆ100mLµÄĮæĶ²ĮæČ”25.00mLŃĪĖį
C.ÓĆpHŹŌÖ½²āµĆijĀČĖ®µÄpHĪŖ4
D.ÓĆ0.2000 mol/LŃĪĖįµĪ¶Ø20.00mLĪ“ÖŖÅضČNaOH£¬ÓĆČ„22.40mLŃĪĖįČÜŅŗ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÄÜŌ“ŹĒČĖĄąÉś»īŗĶÉē»į·¢Õ¹µÄ»ł“”£¬ŃŠ¾æ»Æѧ·“Ó¦ÖŠµÄÄÜĮæ±ä»Æ£¬ÓŠÖśÓŚøüŗƵŲĄūÓĆ»Æѧ·“Ó¦ĪŖÉś²śŗĶÉś»ī·žĪń”£
£Ø1£©ĢģČ»ĘųŗĶæÉČ¼±ł(mCH4nH2O)¼ČŹĒøߊ§½ą¾»µÄÄÜŌ“£¬Ņ²ŹĒÖŲŅŖµÄ»Æ¹¤ŌĮĻ”£
¢ŁæÉČ¼±ł(mCH4nH2O)ŹōÓŚ_____¾§Ģ壬Š“³öCH4µÄ½į¹¹Ź½______”£
¢ŚŅŃÖŖ25”ę”¢101kPaŹ±£¬1g¼×ĶéĶźČ«Č¼ÉÕÉś³ÉŅŗĢ¬Ė®·Å³ö55.65kJČČĮ棬ŌņøĆĢõ¼žĻĀ·“Ó¦CH4(g)+2O2(g)=CO2(g)+2H2O(l)µÄ ”÷H=___kJ/mol”£
£Ø2£©ÓĆ¼×Ķé--ŃõĘų¼īŠŌ(KOHČÜŅŗ)Č¼ĮĻµē³Ų×÷µēŌ“£¬µē½āCuCl2ČÜŅŗ”£·“ӦװÖĆČēĻĀĶ¼ĖłŹ¾£ŗ

¢Łbµē¼«Ćū³ĘĪŖ______£¬dµē¼«µÄµē¼«·“Ó¦Ź½ĪŖ__________”£
¢Ś¼ŁÉčCuCl2ČÜŅŗ×ćĮ棬µ±Ä³µē¼«ÉĻĪö³ö3.2g½šŹōCuŹ±£¬ĄķĀŪÉĻČ¼ĮĻµē³ŲĻūŗĵÄŃõĘųŌŚ±ź×¼×“ŠÖĻĀµÄĢå»żŹĒ_______mL”£
£Ø3£©25”ę£¬101kPaĢõ¼žĻĀ£¬14gN2ŗĶ3gH2·“Ӧɜ³ÉNH3µÄÄÜĮæ±ä»ÆČēĻĀĶ¼ĖłŹ¾£ŗ
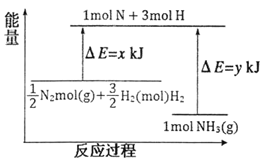
ŅŃÖŖ:¢Łx=1127£»
¢Ś25”ę£¬101kPaĻĀ£¬N2(g)+3H2(g)![]() 2NH3(g) ”÷H=-92kJmol-1”£Ōņy=______”£
2NH3(g) ”÷H=-92kJmol-1”£Ōņy=______”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅ»¶ØĪĀ¶ČĻĀ£¬Āś×ćĻĀĮŠĢõ¼žµÄČÜŅŗŅ»¶Ø³ŹĖįŠŌµÄŹĒ£Ø””””£©
A.ÄÜÓė½šŹōAl·“Ó¦·Å³öH2µÄČÜŅŗ
B.¼Ó·ÓĢŖŗóĻŌĪŽÉ«µÄČÜŅŗ
C.pH=6µÄijČÜŅŗ
D.c£ØH+£©£¾c£ØOH©£©µÄČĪŅāĖ®ČÜŅŗ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅŃÖŖX”¢Y”¢ZČżŌŖĖŲµÄŌ×ÓŠņŹżŅĄ“ĪŌö“ó£¬ŌŚÖÜĘŚ±ķÖŠXµÄŌ×Ó°ė¾¶×īŠ”£¬Y”¢ZŌ×Ó×īĶā²ćµē×ÓŹżÖ®ŗĶĪŖ10”£C”¢DŹĒÓÉX”¢Y”¢ZÖŠĮ½ÖÖŌŖĖŲ×é³ÉµÄ»ÆŗĻĪļ£¬CĶس£×“æöĻĀĪŖĪŽÉ«ŅŗĢ壬 DĪŖĪŽÉ«·ĒæÉČ¼ŠŌĘųĢ壬GĪŖ»ĘĀĢÉ«µ„ÖŹĘųĢ壬J”¢MĪŖ½šŹō£¬IÓŠĘÆ°××÷ÓĆ£¬·“Ó¦¢Ł³£ÓĆÓŚÖĘ×÷Ó”Ė¢µēĀ·°å”£ø÷ĪļÖŹÖ®¼äµÄ×Ŗ»»¹ŲĻµČēĻĀĶ¼£¬²æ·ÖÉś³ÉĪļŹ”ĀŌ”£Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
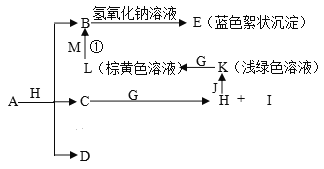
£Ø1£©Š“³öAµÄ»ÆѧŹ½__________________£¬CµÄµē×ÓŹ½______________________£¬
DµÄ½į¹¹Ź½______________________________”£
£Ø2£©½«22.4L£Ø±ź×¼×“æö£©DĘųĢåĶØČė1L 1mol/L NaOHČÜŅŗÖŠ£¬ĶźČ«ĪüŹÕŗó£¬ČÜŅŗÖŠ³żĮĖNa£«Ķā£¬»¹“óĮæ“ęŌŚµÄĄė×ÓŹĒ______________________________”£
£Ø3£©ŅŃÖŖMČÜÓŚĻ”ĻõĖį£¬ČÜŅŗ±ä³ÉĄ¶É«£¬²¢·Å³öĪŽÉ«ĘųĢ唣ĒėŠ“³öøĆ·“Ó¦µÄĄė×Ó·½³ĢŹ½___________________________________________________________”£
£Ø4£©¼ģŃé»ÆŗĻĪļKÖŠŃōĄė×ӵďµŃé·½·ØŹĒ______________________________________
£Ø5£©Š“³ö·“Ó¦K+G”śLµÄ»Æѧ·½³ĢŹ½ŹĒ________________________________________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æČēĶ¼ĖłŹ¾,¼ÆĘųĘæÄŚ³äĀśÄ³»ģŗĻĘųĢå,ÖĆÓŚ¹āĮĮ“¦,½«µĪ¹ÜÄŚµÄĖ®¼·Čė¼ÆĘųĘæŗó,ÉÕ±ÖŠµÄĖ®»į½ųČė¼ÆĘųĘæ,¼ÆĘųĘæÄŚĘųĢåŹĒ(””””)

¢ŁCO”¢O2 ¢ŚCl2”¢CH4 ¢ŪNO2”¢O2 ¢ÜN2”¢H2
A. ¢Ł¢Ś B. ¢Ś¢Ü C. ¢Ū¢Ü D. ¢Ś¢Ū
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com