
四种短周期元素在周期表中的位置如右图,其中只有M为金属元素。下列说法不正确的是
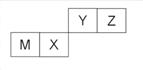
A.原子半径Z<M
B.Y的最离价氧化物对应水化物的酸性比X 的弱
C.X 的最简单气态氢化物的热稳定性比Z的小
D.Z位于元索周期表中第2 周期、第ⅥA族
科目:高中化学 来源: 题型:
类推思维是化学解题中常用的一种思维方法,下列有关离子方程式的类推正确的是( )
|
| 已知 | 类推 |
| A | 将Fe加入CuSO4溶液中 Fe+Cu2+=Cu+Fe2+ | 将Na加入到CuSO4溶液中 2Na+Cu2+=Cu+2Na+ |
| B | 向稀硫酸加入NaOH溶液至中性 H++OH-=H2O | 向H2SO4溶液加入Ba(OH)2溶液至中性 H++OH-=H2O |
| C | 向氯化铝溶液中加入足量NaOH溶液 Al3+ + 4OH- = AlO2- + 2H2O | 向氯化铝溶液中加入足量氨水 Al3+ + 4NH3·H2O = AlO2- + 2H2O +4NH4+ |
| D | 向Ca(OH)2溶液中通入过量CO2 CO2 + OH- = HCO3- | 向Ca(OH)2溶液中通入过量SO2 SO2 + OH- = HSO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
有一化合物X,可发生如下的转化关系(部分反应物、生成物省略)。其中B、D、E、F均为无色气体,W、K为常见的金属单质,C为难溶于水的红褐色固体。在混合液中加入BaCl2溶液可生成不溶于稀盐酸的白色沉淀,H和W反应可放出大量的热。
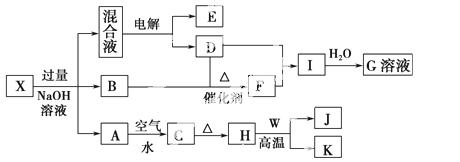
(1)X中滴入过量NaOH溶液的离子方程式为__________________________。
(2)I和水反应生成G的化学方程式为________________________________。
(3)I转化为G的反应中,当有2 mol G生成时,转移的电子数为_______________________________________________________________。
(4)引发H和W反应的操作是________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
用A+、B-、C2-、D、E、F、G和H分别表示含有18个电子的八种粒子(离子或分子),请回答:
(1)A元素是____、B元素是____、C元素是__(用元素符号表示)。
(2)D是由两种元素组成的双原子分子,其分子式是____。
(3)E是所有含18个电子的粒子中氧化能力最强的分子,其分子式是____。
(4)F是由两种元素组成的三原子分子,其分子式是____;电子式是____________。
(5)G分子中含有4个原子,其分子式是__________。
(6)H分子中含有8个原子,其分子式是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
根据原子结构及元素周期律的知识,下列推断正确的是( )
A.同主族元素含氧酸的酸性随核电荷数的增加而减弱
B.核外电子排布相同的微粒化学性质也相同
C.Cl-、S2-、Ca2+、K+半径逐渐减小
D. 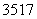 Cl与
Cl与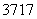 Cl得电子能力相同
Cl得电子能力相同
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关元素的性质及其递变规律正确的是( )
A.IA族与VIIA族元素间可形成共价化合物或离子化合物
B.第二周期元素从左到右,最高正价从+1递增到+7
C.同主族元素的简单阴离子还原性越强,水解程度越大
D.同周期金属元素的化合价越高,其原子失电子能力越强
查看答案和解析>>
科目:高中化学 来源: 题型:
已知X为第三周期元素的原子,该原子要达到8电子稳定结构,则需要的电子数小 于其次外层和最内层的电子数之差,且等于最内层电子数的整数倍。下列说法正确的是( )
A.X元素最高价氧化物对应的水化物一定是强酸
B.X元素的氢化物的化学式一定为H2X
C.X的单质一定是良好的半导体材料
D.X元素的氧化物一定能与烧碱反应
查看答案和解析>>
科目:高中化学 来源: 题型:
周期主族元素A、B、C、D、E、F的原子序数依次增大,它们的原
子核外电子层数之和为13。B的化合物种类繁多,数目庞大;C、D是空气中含量最多的两种元素,D、E两种元素的单质反应可以生成两种不同的离子化合物;F为同周期半径最小的元素。试回答以下问题:
(1)写出D与E以1∶1的原子个数比形成的化合物的电子式:________。F的原子结构示意图为:________。
(2)B、D形成的化合物BD2中存在的化学键为________键(填“离子”或“共价”,下同)。A、C、F三种元素形成的化合物CA4F为________化合物。
(3)化合物甲、乙由A、B、D、E中的三种或四种组成,且甲、乙的水溶液均呈碱性。则甲、乙反应的离子方程式为:____________________________________________。
(4)A、C、D、E的原子半径由大到小的顺序是________(用元素符号表示)。
(5)元素B和F的非金属性强弱,B的非金属性________于F(填“强”或“弱”),并用化学方程式证明上述结论___________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
现拟分离乙酸乙酯、乙酸、乙醇的混合物,如图所示是分离操作步骤流程图。请在相应横线上填入适当的试剂、适当的分离方法及所分离的有关物质的化学式。
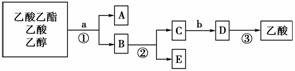
(1)试剂:a________________;b________________。
(2)分离方法:①________;②________;③________。
(3)物质的化学式:A______________;C________________;D________________;E________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com