
 ,B为18电子分子,其结构式为
,B为18电子分子,其结构式为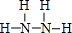 .
.分析 M是地壳中含量最高的金属元素,应为Al;X、Y、Z、L是组成蛋白质的基础元素,有C、N、O、H、P等元素,由于X、Y、Z、L、M五种元素的原子序数依次增大,则X、Y、Z、L分别为H、C、N、O元素.
(1)N、H两元素按原子数目比l:3形成的化合物A为NH3,N、H两元素按原子数目比2:4构成分子B为N2H4,氨气分子中N原子与H原子之间形成1对共用电子对,N2H4分子中N原子之间形成1对共用电子对,N原子与H原子之间形成1对共用电子对;
(2)结合三、四周期容纳元素种数确定与氧原子序数之差,进而计算Se的原子序数;根据最外层电子数分析最高化合价,然后书写最高价氧化物对应的水化物化学式;氨气与氯化氢的反应生成氯化铵;
(3)同主族元素所形成的同一类型的化合物,其结构和性质往往相似,则PH4I与NH4Cl性质相似,根据NH4Cl的性质判断.
解答 解:M是地壳中含量最高的金属元素,应为Al;X、Y、Z、L是组成蛋白质的基础元素,有C、N、O、H、P等元素,由于X、Y、Z、L、M五种元素的原子序数依次增大,则X、Y、Z、L分别为H、C、N、O元素.
(1)N、H两元素按原子数目比l:3形成的化合物A为NH3,N、H两元素按原子数目比2:4构成分子B为N2H4,氨气分子中N原子与H原子之间形成1对共用电子对,其电子式为 ,N2H4分子中N原子之间形成1对共用电子对,N原子与H原子之间形成1对共用电子对,其结构式为
,N2H4分子中N原子之间形成1对共用电子对,N原子与H原子之间形成1对共用电子对,其结构式为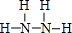 ,
,
故答案为: ;
;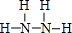 ;
;
(2)Se与O同一主族,Se原子比O原子多两个电子层,即电荷数相差8+18=26,则Se的原子序数为8+26=34,其最高价为+6,最高正价氧化物对应的水化物化学式为H2SeO4;Z的氢化物为氨气,与氯化氢相遇时反应生成氯化铵,有白烟生成,
故答案为:34;H2SeO4;有白烟生成;
(3)同主族元素所形成的同一类型的化合物,其结构和性质往往相似,则PH4I与NH4Cl性质相似,则
A.PH4I与NH4Cl性质相似,都属于离子化合物,故A错误;
B.PH4I与NH4Cl性质相似,具有热不稳定性,加热易分解,分解产物为PH3和HI,HI受热分解得到氢气和紫色的碘蒸气,故B正确;
C.由NH4Cl的性质判断,该化合物能与强碱发生反应生成PH3,故C正确;
D.根据NH4Cl的性质判断,PH3与HI化合可生成PH4I,故D正确;
故答案为:A.
点评 本题考查位置结构与性质关系的应用,题目难度中等,注意根据蛋白质的组成元素结合元素的原子序数关系进行推断,试题培养了学生灵活应用基础知识的能力.


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:选择题
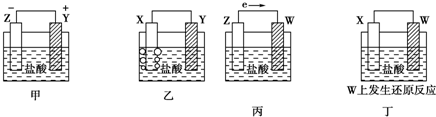
| A. | Z>Y>X>W | B. | Z>X>Y>W | C. | Z>Y>W>X | D. | Y>Z>X>W |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 强氧化性和脱水性 | B. | 强氧化性和吸水性 | ||
| C. | 难挥发性和酸性 | D. | 脱水性和吸水性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
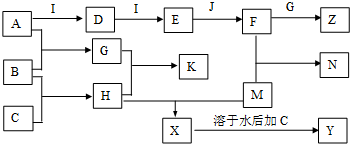
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
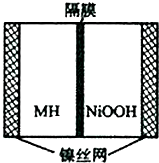 如图是在航天用高压氢镍电池基础上发展起来的一种金属氢化物镍电池(MH-Ni电池).该电池放电时的总反应为:MH+NiOOH=M+Ni(OH)2,下列有关说法不正确的是( )
如图是在航天用高压氢镍电池基础上发展起来的一种金属氢化物镍电池(MH-Ni电池).该电池放电时的总反应为:MH+NiOOH=M+Ni(OH)2,下列有关说法不正确的是( )| A. | 放电时负极反应为:MH+OH--e-→M+H2O | |
| B. | 电池的电解液可为KOH溶液,OH-向负极移动 | |
| C. | 放电时正极反应为:NiOOH+H2O-e-→Ni(OH)2+OH- | |
| D. | MH是一类储氢材料,其氢密度越大,电池的能量密度越高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盖斯定律为我们提供了解决很难由实验直接测定而获得反应热的理论依据 | |
| B. | 若用50mL 0.50mo1•L-1的氢氧化钠溶液,分别与50mL 0.50mo1•L-1的盐酸和50mL 0.25mo1•L-1的硫酸充分反应,两反应测定的反应热不相等 | |
| C. | 实验时只需要记录反应体系的最高温度t即可 | |
| D. | 酸碱混合时,量筒中NaOH溶液应缓缓倒入小烧杯中,再用环形玻璃搅拌棒不断搅拌 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
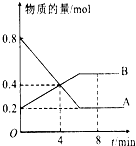 某温度时,在2L容器中A、B两种物质间的转化反应中A、B物质的量随时间变化的曲线如图所示,由图中数据
某温度时,在2L容器中A、B两种物质间的转化反应中A、B物质的量随时间变化的曲线如图所示,由图中数据查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为测定某NaOH溶液的浓度,通常用已润洗的酸式滴定管放出25.00mL标准盐酸溶液于锥形瓶中,加2滴酚酞,然后向已润洗的碱式滴定管中注入未知浓度的NaOH溶液进行滴定 | |
| B. | 用无水CuSO4 、BaCl2溶液、稀盐酸、NaOH溶液、红色石蕊试纸、KSCN溶液、新制氯水等试剂可确定摩尔盐的化学式 | |
| C. | 通常采用产生气泡的快慢,来比较不同条件下Na2S2O3溶液与稀硫酸的反应速率 | |
| D. | 萃取操作所用的分液漏斗使用前应加入少量水,见旋塞芯处是否漏水,待确认不漏水后则可以使用 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 铜片消耗完所需时间 | |
| B. | 反应中氧化剂得到电子总数 | |
| C. | 反应后溶液中铜离子浓度(反应后溶液体积不变) | |
| D. | 反应生成气体的体积(同温、同压) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com