
【题目】Ⅰ.已知下列热化学方程式:
①2C(s)+O2(g)=2CO(g) ΔH=-220.0 kJmol-1;
②C(s)+O2(g)=CO2(g) ΔH =-393.5 kJmol-1;
③2CO(g)+O2(g)=2CO2(g) ΔH =-566.0 kJmol-1;
④CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH =-890.0 kJmol-1。
请回答下列问题:
(1)CO的燃烧热为________________。
(2)炽热的木炭与二氧化碳反应生成一氧化碳的反应为___ (填“放热”或“吸热”)反应,理由是____________。
(3)写出甲烷与氧气反应生成CO的热化学方程式:_________________________。
Ⅱ.常温常压下,一定质量的无水乙醇(C2H5OH)完全燃烧时放出热量Q kJ,其燃烧生成的CO2用过量饱和石灰水吸收可得100 g CaCO3沉淀,请写出乙醇燃烧的热化学方程式__________________________。
【答案】-283.0 kJmol-1吸热由热化学方程式①减去热化学方程式②可得C(s)+CO2(g)=2CO(g) ΔH=+173.5 kJmol-12CH4(g)+3O2(g)=2CO(g)+4H2O(g) ΔH=-1 214.0 kJmol-1C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) ΔH=-2Q kJmol-1
【解析】
Ⅰ. (1) 燃烧热(ΔcH0)是指物质与氧气进行完全燃烧反应时放出的热量;根据反应③2CO(g)+O2(g)=2CO2(g) ΔH3=-566.0 kJmol-1得反应CO(g)+![]() O2(g)=CO2(g) ΔH=-890.0 kJmol-1,由故CO的燃烧热为-283.0 kJmol-1;
O2(g)=CO2(g) ΔH=-890.0 kJmol-1,由故CO的燃烧热为-283.0 kJmol-1;
(2)由热化学方程式①减去热化学方程式②可得C(s)+CO2(g)=2CO(g) ΔH=+173.5 kJmol-1,故炽热的木炭与二氧化碳反应生成一氧化碳的反应为吸热反应;
(3)已知③2CO(g)+O2(g)=2CO2(g) ΔH3=-566.0 kJmol-1;④CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH4=-890.0 kJmol-1;根据盖斯定律,由④×2+③得反应2CH4(g)+3O2(g)=2CO(g)+4H2O(g) ΔH=ΔH4×2+ΔH3=-1 214.0 kJmol-1;
Ⅱ.因生成的CO2用过量饱和石灰水完全吸收,可得100克CaCO3沉淀,CaCO3的物质的量是1mol,由碳元素守恒可知,二氧化碳的物质的量也为1mol,即生成1mol二氧化碳放出的热量为Q,而完全燃烧1摩尔无水乙醇时生成2mol二氧化碳,则放出的热量为Q×2=2Q,热化学方程式为:C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l)△H=-2QkJ/mol。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]氢、氮、氧、铁、铜等元素及其化合物在人们的日常生活中有着广泛的用途。回答下列问题:
(1)写出基态铜原子的价电子排布式__________________
(2)和铜在同一周期中,基态原子未成对电子数为2的元素共有______种。
(3)NH4HF2中HF2-的结构为F-H.......F-,则NH4HF2中含有的化学键有_________
(A)离子键 (B)共价键 (C)金属键 (D)氢键 (E)配位键
(4)写出与NH4+互为等电子体的一种分子和一种离子的化学式_______、_______;
(5)CH3OH分子中C原子的杂化方式为_______,O原子的杂化方式为_______,
键角:H-C-H_______H-O-C。(填“<”、“>”、“=”)
(6)Cu与Cl形成某种化合物的晶胞如下图所示,Cu的配位数是________,该晶体的密度为ρg·cm-3,晶胞边长为acm,则阿伏加德罗常数为__________(用含ρ、a的代数式表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮是重要的非金属元素,其化合物在生产、生活中广泛存在。
(1)键能是指在将1mol理想气体分子AB拆开为中性气态原子A和B所需的能量。已知下列化学键的键能如下表:
化学键 | N≡N | O=O | N—N | N—H | O—H |
键能/ kJ·mol1 | 946 | 497 | 193 | 391 | 463 |
写出1mol气态肼(H2N—NH2)燃烧生成氮气和气态水的热化学方程式________。
(2)用焦炭还原NO的反应为:2NO(g)+C(s)![]() N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
t/min | 0 | 10 | 20 | 30 | 40 |
n(NO)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
n(NO)(乙容器)/mol | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
n(NO)(丙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
① 该反应为________(填“放热”或“吸热”)反应。
② 乙容器在50min时达到平衡状态,则NO的浓度是____________,0~50min内用NO的浓度变化表示的平均反应速率v(NO)=____________。
(3)用焦炭还原NO2的反应为:2NO2(g)+2C(s)![]() N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
① A、C两点的浓度平衡常数关系:Kc(A)______Kc(C)(填“<”、“>”或“=”)。
② A、B、C三点中NO2的转化率最高的是______(填“A”、“B”或“C”)点。

③ 计算B点时该反应的压强平衡常数Kp(B)=______(Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应CO(g)+H2O(g)![]() CO 2(g)+ H 2(g) △H﹤0,在其他条件不变的情况下
CO 2(g)+ H 2(g) △H﹤0,在其他条件不变的情况下
A. 加入催化剂,改变了反应的途径,反应的△H也随之改变
B. 改变压强,平衡不发生移动,反应放出的热量不变
C. 升高温度,反应速率加快,反应放出的热量不变
D. 若在原电池中进行,反应放出的热量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S与CO2高温下发生反应:H2S(g)+CO2(g) ![]() COS(g)+H2O(g)。在610 K时,将0.10 mol CO2与0.40 molH2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
COS(g)+H2O(g)。在610 K时,将0.10 mol CO2与0.40 molH2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
(1)H2S的平衡转化率α1=________%,反应平衡常数K=___________________。
(2)在620K重复实验,平衡后水的物质的量分数为0.03,H2S的转化率α2________α1,该反应的ΔH____0(填“>”“<”或“=”)。
(3)向反应器中再分别充入下列气体,能使H2S转化率增大的是______(填标号)。
A.H2S B.CO2 C.COS D.N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在4 L密闭容器中充入6 mol A气体和5 mol B气体,在一定条件下发生反应:3A(g)+B(g)![]() 2C(g)+xD(g),达到平衡时,生成了2 mol C,经测定,D的浓度为0.5 mol·L-1,下列判断正确的是( )。
2C(g)+xD(g),达到平衡时,生成了2 mol C,经测定,D的浓度为0.5 mol·L-1,下列判断正确的是( )。
A. x=1
B. B的转化率为20%
C. 平衡时A的浓度为1.50 mol·L-1
D. 达到平衡时,在相同温度下容器内混合气体的压强是反应前的85%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应Fe(s) +CO2 (g)![]() FeO(s)+CO(g),700℃时平衡常数为1.47,900℃时平衡常数为2.15。下列说法正确的是
FeO(s)+CO(g),700℃时平衡常数为1.47,900℃时平衡常数为2.15。下列说法正确的是
A. 升高温度该反应的正反应速率增大,逆反应速率减小
B. 该反应的化学平衡常数表达式为K=![]()
C. 绝热容器中进行该反应,温度不再变化,则达到化学平衡状态
D. 该反应的正反应是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜矿是工业冶炼铜的原料,主要成分为 CuFeS2。试回答下列问题:
(1)基态硫原子核外电子有_____种不同运动状态,能量最高的电子所占据的原子轨道形状为_________。
(2)基态Cu原子的价层电子排布式为_________;Cu、Zn的第二电离能大小I2(Cu) _________I2(Zn)(填“>”“<”或“=”)。
(3)SO2分子中S原子的轨道杂化类型为_________,分子空间构型为_________;与SO2互为等电子体的分子有_________(写一种)。
(4)请从结构角度解释H2SO3的酸性比H2SO4酸性弱的原因_________。
(5)Cu(CH3CN)4比四氨合铜离子稳定,其配离子中心原子配位数为_________,配位体中σ键与π键个数之比为_________。
(6)铁镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图所示。

若该晶体储氢时,H2分子在晶胞的体心和棱的中心位置,距离最近的两个H2分子之间距离为anm。则该晶体的密度为_________g/cm3(列出计算表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录如下,则卡片上的描述合理的是
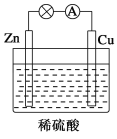

A. ①②③ B. ①②④ C. ②④ D. ③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com