
【题目】Ⅰ.下图是元素周期表的一部分,根据①~⑧在周期表中的位置按题目要求回答:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
二 | ① | ② | ③ | |||||
三 | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
(1)元素①~⑧中,除⑧外,原子半径最大的是___________(填元素符号),元素③、⑦所形成的氢化物的稳定性由强到弱的顺序为__________________(用相应氢化物的化学式作答)元素②的氢化物的电子式是____________。
(2)④⑤⑥三种元素的氢氧化物的碱性由强到弱的顺序是________(用相应氢氧化物的化学式作答),元素①~⑧中的最高价氧化物对应的水化物中酸性最强的酸是_______(填化学式)。
Ⅱ.实验室用密度为1.84g/cm3,溶质的质量分数为98%的硫酸,配制980mL物质的量浓度为0.1mol/L的硫酸。供选用的仪器有:①胶头滴管;②药匙;③烧杯;④量筒;⑤托盘天平。请回答下列问题:
(1)配制上述溶液量取浓硫酸时应选用__________量筒(选填序号)
①10mL ②50mL ③100mL;
(2)配制稀硫酸时,上述仪器中还缺少的仪器有____________________________(写仪器名称),不需要使用的有______________(选填序号);
(3)下列操作使所配溶液的物质的量浓度偏低的是___________。
A.用量筒量取的浓硫酸,慢慢地沿着玻璃棒注入盛有20mL蒸馏水的小烧杯,搅拌后,立即转移到容量瓶中,再按正确操作配制溶液。
B.往容量瓶转移溶液时,有少量液体溅出。
C.未洗涤稀释浓硫酸的小烧杯
D.定容时俯视刻度线。
E.容量瓶未干燥即用来配制溶液。
F.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线。
【答案】Na HF>HC1 ![]() NaOH>Mg(OH)2>Al(OH)3 HC1O4 ① 1000ml容量瓶、玻璃棒 ②⑤ BC
NaOH>Mg(OH)2>Al(OH)3 HC1O4 ① 1000ml容量瓶、玻璃棒 ②⑤ BC
【解析】
Ⅰ.由元素在周期表中的位置可知,①为C,②为N,③为F,④为Na,⑤为Mg,⑥为Al,⑦为Cl,⑧为Ar。
(1)元素原子核外电子层数越多,原子半径越大,对于电子层数相同的元素,原子序数越大,原子半径就越小,所以元素①~⑧中,除⑧外,原子半径最大的是Na元素;
F、Cl是同一主族的元素,由于原子半径Cl>F,所以元素的非金属性F>Cl,元素的非金属性越强,元素形成的氢化物的稳定性就越强,故两种元素的氢化物的稳定性由强到弱的顺序为HF>HCl;
②为N元素,原子最外层有5个电子,与3个H原子形成3对共用电子对,电子式为![]() ;
;
(2)④⑤⑥三种元素分别是Na、Mg、Al,由于元素的原子半径Na>Mg>Al,所以元素的金属性有强到弱的顺序是:Na>Mg>Al,元素的金属性越强,其氢氧化物的碱性就越强,所以三种物质的碱性由强到弱的顺序是NaOH>Mg(OH)2>Al(OH)3;
元素①~⑧中的F非金属性最强,无最高价含氧酸,除此之外,其余元素的最高价氧化物对应的水化物中酸性最强的酸是HClO4;
II.(1)准确配制一定体积、一定物质的量浓度的溶液的仪器是容量瓶,由于在实验室中没有规格为980mL的容量瓶,根据选择仪器的标准:大而近,要选择使用1000mL容量瓶;98%的硫酸物质的量浓度为c=![]() ,溶液在稀释前后溶质的物质的量不变,所以V1×19.8mol/L=1000mL×0.1mol/L,解得V1=5.1mL,故要选择10mL的量筒量取;
,溶液在稀释前后溶质的物质的量不变,所以V1×19.8mol/L=1000mL×0.1mol/L,解得V1=5.1mL,故要选择10mL的量筒量取;
(2)配制稀硫酸时需要10mL量筒、滴管、烧杯、玻璃棒、1000mL容量瓶,所以上述仪器中还缺少的仪器有玻璃棒、1000mL容量瓶;不需要使用的有是药匙、托盘天平;代号是②⑤;
(3) A.用量筒量取的浓硫酸,慢慢地沿着玻璃棒注入盛有20mL蒸馏水的小烧杯,搅拌后,立即转移到容量瓶中,再按正确操作配制溶液,会使溶液的体积偏小,导致溶液的浓度偏高,A错误;
B.往容量瓶转移溶液时,有少量液体溅出,会使溶质的物质的量偏少,导致溶液的浓度偏低,B正确;
C.未洗涤稀释浓硫酸的小烧杯,使溶质的物质的量偏少,导致溶液的浓度偏低,C正确;
D.定容时俯视刻度线,溶液的体积偏少,导致溶液的浓度偏高,D错误;
E.容量瓶未干燥即用来配制溶液,不影响溶液的浓度,E错误;
F.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,对溶液的浓度无影响,F错误;
故合理选项是BC。


科目:高中化学 来源: 题型:
【题目】氧氮杂是新药研制过程中发现的一类重要活性物质,能用于改善大脑缺血。下面是某研究小组提出的一种氧氮杂类化合物E的合成路线:
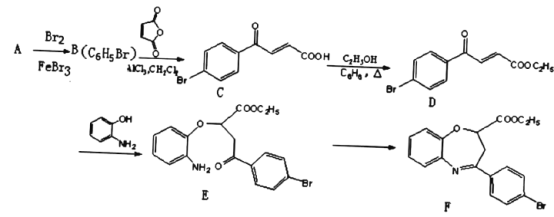
(1)A的结构简式为_____。C中官能团的名称为____。
(2)E→F经历两步反应,其反应类型依次为______、______。
(3)同时满足下列条件的D的一种同分异构体的结构简式为______。
I.分子中含有1个苯环;
II.能发生银镜反应;
III.分子中有5种不同化学环境的氢。
(4)1mol D与足量NaOH溶液反应时最多消耗_____molNaOH。
(5)由E合成F时还可能生成副产物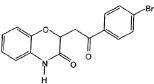 和一种常见的有机物G,G的结构简式为_______。
和一种常见的有机物G,G的结构简式为_______。
(6)已知: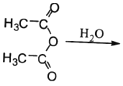 CH3COOH。原料
CH3COOH。原料![]() 俗名“马莱酐”,它是马莱酸
俗名“马莱酐”,它是马莱酸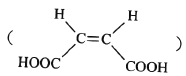 的酸酐。请写出以
的酸酐。请写出以![]() 为原料制备化合物
为原料制备化合物 的合成路线流程图(无机试剂任用)。______
的合成路线流程图(无机试剂任用)。______
合成路线流程图示例如下:CH3CH2OH![]() CH2=CH2
CH2=CH2![]() Br-CH2CH2-Br
Br-CH2CH2-Br
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组用如图装置进行实验,试回答下列问题:

(1)若开始时开关K与a连接,则A极的电极反应式为____________________
B极的Fe发生__________ 腐蚀(填“析氢”或“吸氧”)
(2)若开始时开关K与b连接,下列说法正确的是________(填序号)
①溶液中Na+向A极移动
②从A极处逸出的气体能使湿润的KI淀粉试纸变蓝
③反应一段时间后加适量盐酸可恢复到电解前电解质的浓度
④若标准状况下B极产生2.24 L气体,则溶液中转移0.2 mol电子
且此时装置内总反应的离子方程式为________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z在元素周期表中的相对位置如图所示。下列说法一定正确的是( )
A. 最高正化合价:Z>X
B. X、Y、Z的单质中,Z的熔点最高
C. 若X为非金属元素,则离子半径:Xn->Ym->Zm-
D. 若X为金属元素,则X、Y、Z的最高价氧化物对应水化物中,Y的碱性最强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)实验室制氨气的化学方程式为_________________________。
(2)0.1 mol/LNH4Cl溶液中离子浓度由大到小的顺序为____________________。
(3)已知0.5mol的液态甲醇(CH3OH)在空气中完全燃烧生成CO2气体和液态水时放出350kJ的热量,则表示甲醇燃烧热的热化学方程式为______________________。
(4)已知①C(s)+O2(g)= CO2(g) ΔH1=-393 kJ/mol
②2CO(g)+O2(g)= 2CO2(g) ΔH2=-566 kJ/mol
③TiO2(s)+2Cl2(g)= TiCl4(s)+O2(g) ΔH3=+141 kJ/mol
则TiO2(s)+2Cl2(g)+2C(s)= TiCl4(s)+2CO(g)的 ΔH =__________________。
(5)在25℃下,向浓度均为0.1 mol/L的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成沉淀_____(填化学式)(已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.2×10-20)。
(6)常温下,0.lmol/LNaHCO3溶液的pH大于8,则溶液中c(H2CO3)______c(CO32-)(填“>”、“=”或“<”)。
(7)在25℃下,将a mol/L的氨水与0.01 mol/L的盐酸等体积混合,反应完成后溶液中c(NH4+)=c(Cl-),则溶液显_________性(填“酸”“碱”或“中”),a _________0.01 mol/L(填“>”、“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,苯与氯气在氯化铁催化下连续反应,生成以氯苯、氯化氢为主要产物,邻二氯苯、对二氯苯为次要产物的粗氯代苯混合物。有关物质的沸点、熔点如图,下列说法不正确的是( )
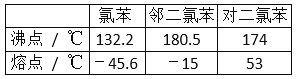
A. 该反应属于取代反应
B. 反应放出的氯化氢可以用水吸收
C. 用蒸馏的方法可将邻二氯苯从有机混合物中首先分离出来
D. 从上述两种二氯苯混合物中,用冷却结晶的方法可将对二氯苯分离出来
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某氯化钾样品中含有少量碳酸钾、硫酸钾和不溶于水的杂质。为了提纯氯化钾,先将样品溶于适量水中,充分搅拌后过滤,再将滤液按如图所示步骤进行操作。下列说法中正确的是
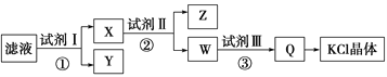
A. 起始滤液的pH=7
B. 试剂Ⅰ为Ba(NO3)2溶液
C. 步骤②中加入试剂Ⅱ的目的是除去Ba2+
D. 图示的步骤中必须要经过2次过滤操作
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“84消毒液”是一种以NaClO为主的高效消毒剂,被广泛用于宾馆、旅游、医院、食品加工行业、家庭等的卫生消毒。某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用。请回答下列问题:


(1)此“84消毒液”的物质的量浓度约为________。(计算结果保留一位小数)
(2)某同学量取100mL此“84消毒液”,按说明要求稀释后用于消毒,则稀释后的溶液中c(Na+)=___mol/L。
(3)该同学参阅读该“84消毒液”的配方,欲用NaClO固体配制480 mL含NaClO质量分数为24%的消毒液。
①如图所示的仪器中配制溶液需要使用的是________________(填仪器序号),还缺少的玻璃仪器是______________。
②该同学配制此溶液需称取称量NaClO固体的质量为_________________g。
(4)若实验遇下列情况,导致所配溶液的物质的量浓度偏高的是____________(填序号)。
a.定容时俯视刻度线 b.转移前,容量瓶内有蒸馏水
c.未冷至室温就转移定容 d.定容时水多加了,用胶头滴管吸出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的CuS和Cu2S的混合物投入足量的HNO3中,收集到气体VL(标况下),向反应后的溶液中(存在Cu2+和SO42-)加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO12.0g,若上述气体为NO和NO2的混合气体,且体积比为1:1,则V可能为( )
A.8.4LB.13.5LC.10.7LD.16.8L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com