
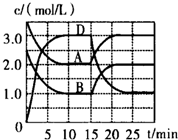 温度为T时,向V L的密闭容器中充入一定量的A和B,发生反应:A(g)+B(g)?C(s)+xD(g)△H>0,容器中A、B、D的物质的量浓度随时间的变化如图所示,下列说法不正确的是( )
温度为T时,向V L的密闭容器中充入一定量的A和B,发生反应:A(g)+B(g)?C(s)+xD(g)△H>0,容器中A、B、D的物质的量浓度随时间的变化如图所示,下列说法不正确的是( )| A. | 反应在前10min的平均反应速率v(B)=0.15mol/(L•min) | |
| B. | 该反应的平衡常数表达式K=$\frac{{c}^{2}(D)}{c(A)•c(B)}$ | |
| C. | 若平衡时保持温度不变,压缩容器体积平衡向逆反应方向移动 | |
| D. | 反应至1.5min时,改变的反应条件是降低温度 |
分析 A.由图象可知,10min时到达平衡,平衡时B的浓度变化量为:2.5mol/L-1.0mol/L=1.5mol/L,根据v=$\frac{△c}{△t}$计算v(B);
B.由图可知,平衡时A、D的浓度变化量分别为1.5mol/L、3mol/L,利用浓度变化量之比等于化学计量数之比计算x的值.化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,据此书写,注意固体、纯液体不需要写出;
C.由图可知,平衡时A、D的浓度变化量分别为1.5mol/L、3mol/L,利用浓度变化量之比等于化学计量数之比计算x的值,增大压强平衡向体积减小的方向移动,据此解答;
D.由图可知,改变条件瞬间,反应混合物的浓度不变,平衡向逆反应移动,该反应正反应为吸热反应,故改变条件应是降低温度.
解答 解:A.由图象可知,10min时到达平衡,平衡时B的浓度变化量为:2.5mol/L-1.0mol/L=1.5mol/L,则v(B)=$\frac{1.5mol/L}{10min}$=0.15mol•L-1•min-1,故A正确;
B.由图可知,平衡时A、D的浓度变化量分别为1.5mol/L、3mol/L,故1:x=1.5mol/L:3mol/L,所以x=2,可逆反应A(g)+B(g)?C(s)+xD(g)的平衡常数表达式K=$\frac{{c}^{2}(D)}{c(A)•c(B)}$,故B正确;
C.由图可知,平衡时A、D的浓度变化量分别为1.5mol/L、3mol/L,故1:x=1.5mol/L:3mol/L,所以x=2,反应前后气体的体积不变,增大压强平衡不移动,故C错误;
D.由图可知,改变条件瞬间,反应混合物的浓度不变,平衡向逆反应移动,该反应正反应为吸热反应,故改变条件应是降低温度,故D正确;
故选C.
点评 本题考查化学平衡图象及有关计算、化学平衡影响因素、反应速率计算、化学平衡常数等知识,题目难度中等,注意理解外界条件对化学平衡的影响,确定x值是关键,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用硅酸钠与盐酸反应制备硅胶:SiO32-+2H+═H2SiO3(胶体) | |
| B. | FeI2溶液中通入少量Cl2:2Fe2++Cl2═2Fe3++2Cl- | |
| C. | 少量NaHSO4 溶液与Ba(OH)2 溶液反应:H++OH-+SO42-+Ba2+═H2O+BaSO4↓ | |
| D. | FeCl3溶液中通入SO2,溶液黄色褪去:2Fe3++SO2+2H2O═2Fe2++SO42-+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
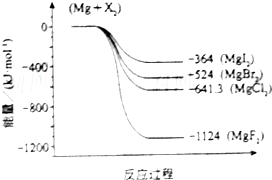 镁化合物和氯气均具有广泛用途,请回答下列问题:
镁化合物和氯气均具有广泛用途,请回答下列问题:
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
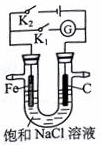
| A. | K1闭合,向铁棒附近滴入K3[Fe(CN)6]溶液,立即有血红色出现 | |
| B. | K2闭合,电流方向由石墨棒经导线流向铁棒 | |
| C. | K2闭合,碳棒上发生还原反应,会生成黄绿色气体 | |
| D. | 将U型管支管封闭并闭合K1一段时间后,U型管中右侧液面会高于左侧液面 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com