
| A. | 过氧化钠的电子式: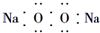 | |
| B. | 碳正离子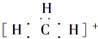 中质子数与电子数的比值为3:2 中质子数与电子数的比值为3:2 | |
| C. | 硫离子的结构示意图: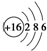 | |
| D. | 质子数为35、中子数为45的溴原子:${\;}_{35}^{80}$Br |
分析 A、氧化钠是由2个钠离子与1个阳离子通过离子键结合而成的离子化合物;
B、质子数为6+3=9,电子数为9-1=8;
C、硫离子的核电荷数为16,核外电子总数为18,最外层含有8个电子;
D、元素符号左下角数字表示质子数、左上角数字表示质量数;
解答 解:A、过氧化钠是由2个钠离子与1个过氧根离子通过离子键结合而成的离子化合物,电子式为: ,故A错误;
,故A错误;
B、碳正离子的质子数为9,核外电子数为8,质子数与电子数之比值为9:8,故B错误;
C、硫离子核外存在18个电子,核内有16个质子,最外层达到8电子稳定结构,其离子结构示意图为: ,故C错误;
,故C错误;
D、元素符号左下角数字表示质子数、左上角数字表示质量数,质子数为35、中子数为45的溴原子的质量数=35+45=80,所以该原子可以表示为:8035Br,故D正确;
故选D.
点评 本题考查了化学基本用语,难度不大,应注意离子化合物和共价化合物电子式的区别,注意掌握基础.


 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
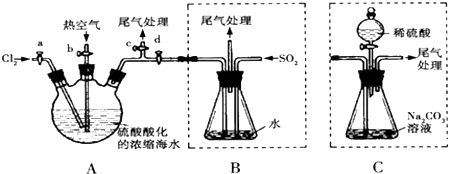
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 35Cl和37Cl的原子结构示意图相同 | |
| B. | 元素H只有11H和21H两种核素 | |
| C. | 元素周期表中位于金属和非金属分界线附近的元素属于过渡元素 | |
| D. | 1mol HCl分子和1mol HF分子断键需要的能量前者大于后者 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Z>W>Y>X | |
| B. | X的简单氢化物与足量W单质在光照条件下反应生成物均为气体 | |
| C. | 气态氢化物的稳定性:Z>W | |
| D. | Y的最高价氧化物对应的水化物可与其简单氢化物发生化合反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
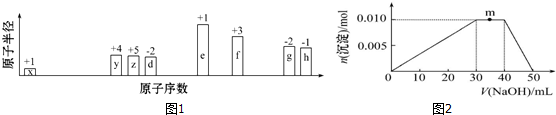
 (或
(或 、
、 ).
).查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
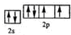 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
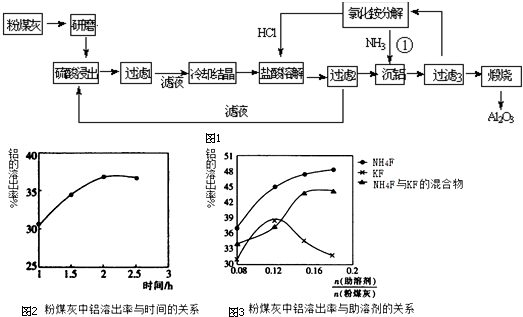
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com