
【题目】蓄电池是一种可以反复充电、放电的装置。有一种蓄电池在充电和放电时发生的反应为NiO2+ Fe+2H2O![]() Fe(OH)2+Ni(OH)2。下列有关该电池的说法中正确的是
Fe(OH)2+Ni(OH)2。下列有关该电池的说法中正确的是
A.放电时电解质溶液显强酸性
B.充电时阳板反应为Ni(OH)2+2OH--2e-=NiO2+2H2O
C.放电时正极附近溶液pH减小
D.充电时阴极附近溶液的碱性保持不变
科目:高中化学 来源: 题型:
【题目】实验室用下图装置完成表中的四个实验,不能达到实验目的的是
实验装置 | 实验目的 | 试剂X | 试剂Y | |
| A. | 检验C2H5Br消去反应后的气体产物 | 水 | 酸性KMnO4溶液 |
B. | 检验C2H5OH消去反应后的气体产物 | NaOH溶液 | Br2的CCl4溶液 | |
C. | 比较醋酸、碳酸、苯酚酸性强弱 | NaOH溶液 | 苯酚钠溶液 | |
D. | 检验制取乙炔时的气体产物 | CuSO4溶液 | 酸性KMnO4溶液 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NaHSO3溶液显酸性,溶液中存在以下平衡:
![]() + H2O
+ H2O![]() H2SO3 + OH- ①
H2SO3 + OH- ①
![]()
![]() H+ +
H+ + ![]() ②
②
向0.1mol·L-1的NaHSO3溶液中分别加入以下物质,下列有关说法正确的是
A.加入少量金属Na,平衡①左移,平衡②右移,溶液中c(![]() )增大
)增大
B.加入少量Na2SO3固体,则c(H+) + c(Na+) = c(![]() ) + c(OH-) +
) + c(OH-) +![]() c(
c(![]() )
)
C.加入少量NaOH溶液,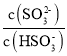 、
、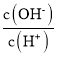 的值均增大
的值均增大
D.加入氨水至中性,则2c(Na+) = c(![]() )>c(H+) = c(OH-)
)>c(H+) = c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请用序号填空:
①13C与14C ②正丁烷与异丁烷
③CH3CH3与CH3CH2CH3 ④
(1)属于同位素的是______;
(2)属于同系物的是______;
(3)属于同分异构体的是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将洁净的金属片甲、乙、丙、丁分别放置在浸有某种盐溶液的滤纸上面并压紧(如图所示)。
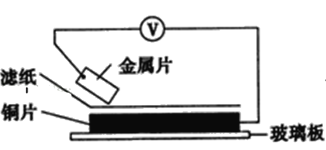
在每次实验时,记录电压指针的移动方向和电压表的读数如下表:(已知构成两电极的金属其金属活泼性相差越大,电压表的读数越大)依据记录数据判断,下列结论中正确的是( )
金属 | 电子流动方向 | 电压(V) |
甲 | 甲→Cu | +0.78 |
乙 | Cu→乙 | -0.15 |
丙 | 丙→Cu | +1.35 |
丁 | 丁→Cu | +0.30 |
A.金属乙能从硫酸铜溶液中置换出铜
B.甲、乙形成合金时,将该合金露置在空气中,甲先被腐蚀
C.在四种金属中乙的还原性最强
D.甲、丁若形成原电池时,甲为正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】20℃时,将足量的BaSO4固体溶于50mL水中,充分搅拌,慢慢加入Na2CO3固体,搅拌,溶液中随c(CO32-)增大时c(Ba2+)变化曲线如下图。则下列说正确的是
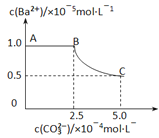
A. 20℃时Ksp(BaSO4)>Ksp(BaCO3)
B. 加入Na2CO3固体立即有BaCO3固体生成
C. BaCO3的Ksp=2.5×10-10
D. 曲线BC段内,c(CO32-):c(SO42-)=25
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定环境中能大量共存的是( )
A.在 =1013的溶液中:NH4+、Ca2+、Cl-、K+
=1013的溶液中:NH4+、Ca2+、Cl-、K+
B.由水电离出的c(H+)=1×10-13mol/L的溶液中:Na+、HCO3-、Cl-、K+
C.无色溶液中可能大量存在Al3+、NH4+、Cl-、S2-
D.中性溶液中可能大量存在Fe3+、K+、Cl-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向IL0.1mol/LNH4Cl溶液中,不断加入固体NaOH后,NH4+与NH3·H2O的变化趋势如右图所示(不考虑体积变化和氨的挥发),下列说法不正确的是
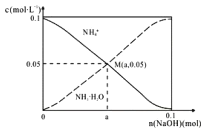
A.M点溶液中水的电离程度比原溶液小
B.在M点时,n(OH-)-n(H+)=(a-0.05)mol
C.随者NaOH的加入,c(H+)/c(NH4+)不断增大
D.当n(NaOH)=0.1mol时,c(OH-)>c(Cl-)-c(NH3·H20)
查看答案和解析>>
科目:高中化学 来源: 题型:
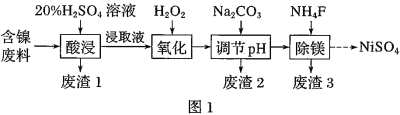
【题目】某含镍![]() 废料中有FeO、
废料中有FeO、![]() 、MgO、
、MgO、![]() 等杂质,用此废料提取
等杂质,用此废料提取![]() 的工艺流程如图1:
的工艺流程如图1:
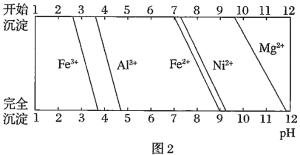
已知:①有关金属离子生成氢氧化物沉淀所需的pH如图.
②![]() 时,
时,![]() 的电离常数
的电离常数![]() 的电离常数
的电离常数![]() ,
,![]()
![]() .
.
(1)加![]() 调节溶液的pH至5,得到废渣2的主要成分是______
调节溶液的pH至5,得到废渣2的主要成分是______![]() 填化学式
填化学式![]() .
.
(2)![]() 能与饱和
能与饱和![]() 溶液反应产生
溶液反应产生![]() ,请用化学平衡移动原理解释
,请用化学平衡移动原理解释![]() 用必要的文字和离子方程式回答
用必要的文字和离子方程式回答![]() ______.
______.
(3)![]() 时,
时,![]() 的NaF溶液中
的NaF溶液中![]() ______
______![]() 列出计算式即可
列出计算式即可![]() 溶液呈______
溶液呈______![]() 填“酸性”、“碱性”或“中性”
填“酸性”、“碱性”或“中性”![]() .
.
(4)已知沉淀前溶液中![]() ,当除镁率达到
,当除镁率达到![]() 时,溶液中
时,溶液中![]() ______
______![]() .
.
(5)在NaOH溶液中用NaClO与![]() 反应可得
反应可得![]() ,化学方程式为____________;
,化学方程式为____________;![]() 与贮氢的镧镍合金可组成镍氢碱性电池
与贮氢的镧镍合金可组成镍氢碱性电池![]() 溶液
溶液![]() ,工作原理为:
,工作原理为:![]() ,负极的电极反应式:______.
,负极的电极反应式:______.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com