
【题目】常温下,用0.01molL-1的NaOH溶液滴定20mL同浓度的HCN溶液,滴定曲线如图所示,下列说法正确的是( )

A. Ka(HCN)的数量级为10-8
B. 点①时,向溶液中滴入几滴1mol/L的HCN溶液,溶液中c(H+)/ c(HCN)的值增大
C. 点②时,溶液中微粒浓度大小关系:c(HCN)>c(Na+)>c(CN-)>c(OH-)>c(H+)
D. 在标示的四种情况中,水的电离程度最大的是②
【答案】C
【解析】
A.根据图像可知,①时为HCN溶液,其c(H+)约为10-6mol/L,Ka(HCN)= c(H+)×c(CN-)/c(HCN)=10-6×10-6/0.01=10-10,数量级约为10-10;
B. 点①时,向溶液中滴入几滴1mol·L-1的HCN溶液为加水稀释的逆过程,加水稀释平衡向电离的方向移动,逆过程为生成分子的方向移动,c(H+)减小,c(HCN)增大,![]() 的值减小;
的值减小;
C. 点②时,溶液为NaCN与HCN混合液,且物质的量相等,此时溶液显碱性,水解程度大于电离程度,则c(HCN)>c(Na+)>c(CN-),由于水解是少量的水解,则c(CN-)>c(OH-);
D. 在标示的四种情况中,③刚好生成NaCN盐,水解程度最大;
A.根据图像可知,①时为HCN溶液,其c(H+)约为10-6mol/L,Ka(HCN)= c(H+)×c(CN-)/c(HCN)=10-6×10-6/0.01=10-10,数量级约为10-10,A错误;
B. 点①时,向溶液中滴入几滴1mol·L-1的HCN溶液为加水稀释的逆过程,加水稀释平衡向电离的方向移动,逆过程为生成分子的方向移动,c(H+)减小,c(HCN)增大,![]() 的值减小,B错误;
的值减小,B错误;
C. 点②时,溶液为NaCN与HCN混合液,且物质的量相等,此时溶液显碱性,水解程度大于电离程度,则c(HCN)>c(Na+)>c(CN-),由于水解是少量的水解,则c(CN-)>c(OH-),C正确;
D. 在标示的四种情况中,③刚好生成NaCN盐,水解程度最大,D错误;
答案为C


 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】羰基硫(COS)与氢气或与水在催化剂作用下的反应如下:
Ⅰ.COS(g)+H2(g)![]() H2S(g)+CO(g) △H1=-17kJ/mol;
H2S(g)+CO(g) △H1=-17kJ/mol;
Ⅱ.COS(g)+H2O(g)![]() H2S(g)+CO2(g) △H2=-35kJ/mol。
H2S(g)+CO2(g) △H2=-35kJ/mol。
回答下列问题:
(1)两个反应在热力学上趋势均不大,其原因是:________________。
(2)反应CO(g)+H2O(g)![]() H2(g)+CO2(g)的△H=_______。
H2(g)+CO2(g)的△H=_______。
(3)羰基硫、氢气、水蒸气共混体系初始投料比不变,提高羰基硫与水蒸气反应的选择性的关键因素是______。
(4)在充有催化剂的恒压密闭容器中只进行反应Ⅰ![]() 设起始充入的n(H2):n(COS)=m,相同时间内测得COS转化率与m和温度(T)的关系如图所示:
设起始充入的n(H2):n(COS)=m,相同时间内测得COS转化率与m和温度(T)的关系如图所示:

①m1______m2(填“![]() ”、“
”、“![]() ”或“
”或“![]() ”
”![]() 。
。
②温度高于T0,COS转化率减小的可能原因为:i有副应发生;ii______;iii______。
(5)在充有催化剂的恒压密闭容器中进行反应Ⅱ.COS(g)与H2O(g)投料比分别为1:3和1:1,反应物的总物质的量相同时,COS(g)的平衡转化率与温度的关系曲线如图所示:
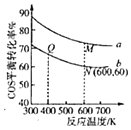
①M点对应的平衡常数______Q点![]() 填“
填“![]() ”、“
”、“![]() ”或“
”或“![]() ”
”![]() ;
;
②N点对应的平衡混合气中COS(g)物质的量分数为______;
③M点和Q点对应的平衡混合气体的总物质的量之比为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知亚磷酸(H3PO3)的结构如图 ,具有强还原性的弱酸,可以被银离子氧化为磷酸。
,具有强还原性的弱酸,可以被银离子氧化为磷酸。
(1)已知亚磷酸可由PCl3水解而成,请写出相应的离子方程式__________.
(2)Na2HPO3是____(填“正盐”或“酸式盐”) 正盐
(3)亚磷酸与银离子反应时氧化剂与还原剂的物质的量之比为______________;
(4)某温度下,0.10molL-1的H3PO3溶液的pH为1.6,即c(H+)=2.5×10-2molL-1,该温度下H3PO3的电离平衡常数K=___________________;(H3PO3第二步电离忽略不计,结果保留两位有效数字)
(5)向H3PO3溶液中滴加NaOH溶液至中性,所得溶液中:c(Na+)_____c(H2PO3-)+2c(HPO32-)(填“>”、“<”或“=”,下同);在NaH2PO3溶液中,c(H+)+c(H3PO3)_____c(HPO32-)+c(OH-)
(6)向某浓度的亚磷酸中滴加NaOH溶液,其pH与溶液中的H3PO3、H2PO3-、HPO32-的物质的量分数a(X)(平衡时某物种的浓度与整个物种浓度之和的比值)的关系如图所示。

以酚酞为指示剂,当溶液由无色变为浅红色时,发生主要反应的离子方程式是_____________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】螺环化合物具有抗菌活性,用其制成的药物不易产生抗药性,螺[3,4]辛烷的结构如图,下列有关螺[3,4]辛烷的说法正确的是( )

A. 分子式为C8H16B. 分子中所有碳原子共平面
C. 与2—甲基—3—庚烯互为同分异构体D. 一氯代物有4种结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E都是前20号元素中的常见元素,且核电荷数递增。A原子没有中子;B原子次外层电子数与最外层电子数之差等于电子层数;C元素是地壳中含量最高的元素;4.6gD单质与足量盐酸作用可产生2.24LH2(标准状态下);E的一价阴离子的核外电子排布与Ar的核外电子排布相同。请回答下列问题:
(1)写出A、B、D的元素符号:A____;B_____;D_____。
(2)C离子的电子式_____;E的离子结构示意图_____;
(3)实验室里检验E的单质常用的试剂是____;
(4)写出电解D、E形成化合物的水溶液的化学反应方程式_____;
(5)写出由A、B、C、D形成的化合物与由A、C、E形成的化合物发生反应的化学反应方程式_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】青蒿素是烃的含氧衍生物,为无色针状晶体,易溶于丙酮、氯仿和苯中,在甲醇、乙醇、乙醚、石油醚中可溶解,在水中几乎不溶,熔点为156-157℃,热稳定性差,青蒿素是高效的抗疟药。已知:乙醚沸点为35℃,从青蒿中提取青蒿素的方法之一是以萃取原理为基础的,主要有乙醚浸取法和汽油浸取法。乙醚浸取法的主要工艺如图所示:

(1)对青蒿干燥破碎后,加入乙醚的目的是______。
(2)操作Ⅰ需要的玻璃仪器主要有烧杯、______,操作Ⅱ的名称是______。
(3)操作Ⅲ的主要过程可能是______(填字母)。
A. 加水溶解,蒸发浓缩、冷却结晶B. 加95%的乙醇,浓缩、结晶、过滤C. 加入乙醚进行萃取分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是电解CuCl2溶液的装置,其中c、d为石墨电极,则下列有关判断正确的是

A. 电解过程中,d电极质量增加 B. 电解过程中,氯离子浓度不变
C. a为负极,b为正极 D. a为阳极,b为阴极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】朱自清在《荷塘月色》中写道:“薄薄的青雾浮起在荷塘里…月光是隔了树照过来的,高处丛生的灌木,落下参差的斑驳的黑影…”月光穿过薄雾形成的种种美景的本质原因是
A. 光是一种胶体 B. 雾是一种胶体
C. 发生丁达尔效应 D. 空气中的小水滴颗粒直径大小约为1nm~100nm
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com