
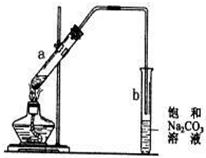
| A、在试管a中先加入2mL浓硫酸,不断摇动试管缓缓加入3mL乙醇和2mL冰醋酸 |
| B、b中导管末端不能插入液面是为了防倒吸 |
| C、实验结束后b试管底部会出现油状液体 |
| D、由于乙醇过量,实验结束后a中不再存在乙酸 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CO2通入饱和碳酸钠溶液中 |
| B、在稀硫酸中加入铜粉,再加入KNO3固体 |
| C、NO2通入FeSO4溶液中 |
| D、SO2通入饱和CaCl2溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 实现现象 |
| (1)取少量该溶液,加几滴甲基橙 | 溶液变红色 |
| (2)取少量该溶液加热浓缩,加Cu片和浓H2SO4,加热 | 有无色气体产生,气体遇空气中以变成红棕色 |
| (3)取少量该溶液,加BaCl2溶液 | 有白色沉淀生成 |
| (4)取(3)中上层清液,加AgNO3溶液 | 有稳定的白色沉淀生成,且不溶于HNO3 |
| (5)取少量该溶液,加NaOH溶液 | 有白色沉淀生成,当NaOH过量时沉淀部分溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:
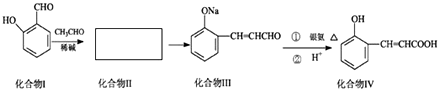
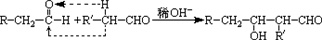
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D | |
| 电解质溶液 | HBr | AgNO3 | BaCl2 | KOH |
| pH变化 | 变小 | 变大 | 不变 | 变大 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
 实验室制取乙酸乙酯的主要步骤如图:
实验室制取乙酸乙酯的主要步骤如图:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com