
 电解原理在化学工业中有广泛的应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,且通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛的应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,且通过导线与直流电源相连.请回答以下问题:分析 (1)电解饱和食盐水时,阳极上是氯离子失电子,阴极上是氢离子得电子,溶液中氢氧根离子浓度增大,遇到酚酞变红色;
(2)根据电解精炼铜的工作原理知识:阳极是粗铜,发生氧化反应,阴极是纯铜,发生还原反应来回答;
(3)电镀原理:镀件是阴极,镀层金属是阳极,电镀液是含有镀层金属阳离子的盐.
解答 解:(1)①和电源的负极相连的电极X极是阴极,该电极上氢离子发生得电子的还原反应,即2H++2e-=H2↑,
故答案为:2H++2e-=H2↑;
②和电源的正极相连的电极Y极是阳极,该电极上氯离子发生失电子的氧化反应,即2Cl--2e-=Cl2↑,故答案为:2Cl--2e-=Cl2↑;
(2)①电解方法精炼粗铜,电解池的阴极X材料是纯铜,电极反应为:Cu2++2e-=Cu,故答案为:精铜;Cu2++2e-=Cu;
②电解方法精炼粗铜,电解池的阳极材料是粗铜,电极反应为:Cu-2e-=Cu2+,故答案为:粗铜;Cu-2e-=Cu2+;
③若电路中有0.04mole-通过时,阴极电极反应为:Cu2++2e-=Cu,则阴极增重0.02mol×64g/mol=1.28g,故答案为:1.28;
(3)①欲在电槽中实现铁上镀锌,则阴极X材料是Fe,发生反应:Zn2++2e-=Zn,故答案为:Fe;Zn2++2e-=Zn;
②阳极材料是金属锌,发生失电子的氧化反应,即Zn-2e-=Zn2+,故答案为:Zn;Zn-2e-=Zn2+;
③电镀液是含有锌离子的可溶性的盐,如ZnSO4、ZnCl2等,故答案为:ZnSO4;ZnCl2.
点评 本题考查学生电解池的工作原理知识,粗铜精炼原理分析,可以根据所学知识进行回答,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 加热0.1mol/L Na2CO3溶液时,CO32-的水解程度和溶液的pH均增大 | |
| B. | 100℃时水的离子积常数Kw为5.5×10-13,说明水的电离是放热反应 | |
| C. | 若在海轮外壳上附着一些铜块,则可以减缓海轮外壳的腐蚀 | |
| D. | 0.1 mol•L-1CH3COOH溶液加水稀释后,CH3COOH的电离程度和溶液中C(CH3COO-)的值增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气能使干燥的有色布条褪色 | |
| B. | 能使湿润的淀粉KI 试纸变蓝的物质一定是氯气 | |
| C. | 电解饱和食盐水可制得氯气 | |
| D. | 氯原子和氯离子的化学性质相似,都具有强氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入少量水,v(H2)不变 | B. | 加入CH3COONa固体,v(H2)减小 | ||
| C. | 加入NH4HSO4固体,v(H2)不变 | D. | 滴加少量CuSO4溶液,v(H2)减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
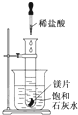 如图所示,把盛有几小块镁片的试管放入盛有25℃的饱和石灰水的烧杯中,再用滴管向试管中滴入2mL的稀盐酸.下列对烧杯中的实验现象的描述及原因说明中正确的是( )
如图所示,把盛有几小块镁片的试管放入盛有25℃的饱和石灰水的烧杯中,再用滴管向试管中滴入2mL的稀盐酸.下列对烧杯中的实验现象的描述及原因说明中正确的是( )| A. | 烧杯中出现白色浑浊,原因是试管中的反应放出热量使烧杯中饱 和石灰水温度升高,溶质析出 | |
| B. | 烧杯中出现白色浑浊,原因是试管中的反应吸收热量使烧杯中饱和石灰水温度降低,溶质析出 | |
| C. | 烧杯中没有任何现象,原因是试管中的反应与烧杯中饱和石灰水没有关系 | |
| D. | 烧杯中没有任何现象,原因是试管中的反应既不放出热量,也不吸收热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使酚酞试液变红的溶液:Na+、Cl-、SO42-、Fe3+ | |
| B. | 使紫色石蕊试液变红的溶液:Fe2+、Mg2+、CO32-、Cl- | |
| C. | 碳酸氢钠溶液:K+、SO42-、Cl-、H+ | |
| D. | pH>7的溶液:K+、Ba2+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com