
【题目】铜生锈会生成铜绿[Cu2(OH)2CO3],铜绿受热易分解,化学方程式为:Cu2(OH)2CO3 ![]() 2CuO+H2O+CO2↑。
2CuO+H2O+CO2↑。
(1)部分锈蚀成铜绿的铜片隔绝空气加热,完全反应后固体质量减少了9.3g,则生锈的铜片中铜绿的质量为___________g
(2)将35g表面已锈蚀成铜绿[Cu2(OH)2CO3]的铜片投入100mL一定浓度的硝酸中;充分反应后,硝酸被还原成NO2和NO,测得反应后溶液PH值为1。往反应后的溶液中加入过量的NaOH溶液,滤出沉淀,洗涤,干燥后得到39.2g蓝色固体。(假设反应前后溶液的体积不变)
①已锈蚀的铜片中的铜元素的质量分数为________。(保留两位小数)
②铜片中单质铜的物质的量为________mol。
(3)若生成NO2和NO混合气体共a L(S.P.T)。
①求a的取值范围(写出详细解答过程)________。
②求原硝酸的物质的量浓度(用含a的代数式表示,写出详细解答过程)________。
【答案】33.3 73.14% 0.2 Cu与硝酸反应,假设只生成NO,由方程式3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O可知,Cu为0.2mol,则NO为![]() mol,其体积为
mol,其体积为![]() mol×22.4L/mol=
mol×22.4L/mol=![]() L, Cu与硝酸反应,假设只生成NO2,由方程式Cu+4HNO3=Cu(NO3)2+2NO2↑+2H2O可知,Cu为0.2mol,则NO为0.4mol,其体积为0.4mol×22.4L/mol=8.96L,实际上生成的是两种气体,则体积在两者之间,即
L, Cu与硝酸反应,假设只生成NO2,由方程式Cu+4HNO3=Cu(NO3)2+2NO2↑+2H2O可知,Cu为0.2mol,则NO为0.4mol,其体积为0.4mol×22.4L/mol=8.96L,实际上生成的是两种气体,则体积在两者之间,即![]() <a<8.96 表面已锈蚀成铜绿[Cu2(OH)2CO3]的铜片与硝酸反应生成硝酸铜和氮的氧化物,溶液中还有剩余的硝酸,加NaOH溶液硝酸铜转化为氢氧化铜沉淀, Cu(OH)2的物质的量为
<a<8.96 表面已锈蚀成铜绿[Cu2(OH)2CO3]的铜片与硝酸反应生成硝酸铜和氮的氧化物,溶液中还有剩余的硝酸,加NaOH溶液硝酸铜转化为氢氧化铜沉淀, Cu(OH)2的物质的量为![]() =0.4mol,
=0.4mol,
![]()
反应后溶液pH为1,溶液中剩余的硝酸为0.1mol/L×0.1L=0.01mol,所以硝酸的总物质的量为0.8mol+0.01mol+![]() mol,所以硝酸的浓度为(8.1+
mol,所以硝酸的浓度为(8.1+![]() )mol/L
)mol/L
【解析】
(1)固体减少的质量为二氧化碳和水的质量之和,根据方程式计算铜绿的质量;
(2)①39.2g蓝色固体为氢氧化铜,根据Cu原子守恒计算Cu元素的质量,再求出Cu的质量分数;
②设固体中Cu2(OH)2CO3的物质的量为xmol,Cu的物质的量为ymol,根据铜原子守恒和已知质量列式计算;
(4)①Cu与硝酸反应,Cu失去的电子的物质的量等于气体得到的电子的物质的量,假设只生成NO求出气体的体积,或者假设只生成NO2再求出气体的体积,实际上生成的是两种气体,则体积在两者之间;
②表面已锈蚀成铜绿[Cu2(OH)2CO3]的铜片与硝酸反应生成硝酸铜和氮的氧化物,溶液中还有剩余的硝酸,根据氮原子守恒计算。
(1)固体减少的质量为二氧化碳和水的质量之和,则二氧化碳和水的质量之和为9.3g,设铜绿的质量为xg,
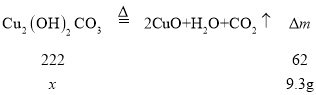
则x=![]() =33.3g;故答案为:33.3;
=33.3g;故答案为:33.3;
(2)39.2g蓝色固体为氢氧化铜,则氢氧化铜中Cu元素的质量为![]() =25.6g,则Cu的质量分数为
=25.6g,则Cu的质量分数为![]() ×100%=73.14%;故答案为:73.14%;
×100%=73.14%;故答案为:73.14%;
(3)设固体中Cu2(OH)2CO3的物质的量为xmol,Cu的物质的量为ymol,已知铜绿和铜的总质量为35g,生成氢氧化铜沉淀的质量为39.2g,则222x+64y=35g, 98(2x+y)=39.2g,解得:x=0.1,y=0.2,故答案为:0.2;
(4)①Cu与硝酸反应,假设只生成NO,由方程式3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O可知,Cu为0.2mol,则NO为![]() mol,其体积为
mol,其体积为![]() mol×22.4L/mol=
mol×22.4L/mol=![]() L, Cu与硝酸反应,假设只生成
L, Cu与硝酸反应,假设只生成![]() <a<8.96;故答案为:
<a<8.96;故答案为:![]() <a<8.96;
<a<8.96;
②表面已锈蚀成铜绿[Cu2(OH)2CO3]的铜片与硝酸反应生成硝酸铜和氮的氧化物,溶液中还有剩余的硝酸,加NaOH溶液硝酸铜转化为氢氧化铜沉淀, Cu(OH)2的物质的量为![]() =0.4mol,
=0.4mol,
![]()
反应后溶液pH为1,溶液中剩余的硝酸为0.1mol/L×0.1L=0.01mol,所以硝酸的总物质的量为0.8mol+0.01mol+![]() mol,所以硝酸的浓度为(8.1+
mol,所以硝酸的浓度为(8.1+![]() )mol/L;故答案为:(8.1+
)mol/L;故答案为:(8.1+![]() )mol/L。
)mol/L。


 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源: 题型:
【题目】往硫酸与硝酸的混合溶液中投入一块未除氧化膜的铝箔,微热使之完全反应,产生2.24 L (已折算为标准状况)NO与H2的混合气体,且该混合气体的平均摩尔质量为13.20 g/mol。
(1)混合气体中NO的体积分数为_________。
(2)若将所得混合气体与一定量的氧气在一定条件下充分反应后,恰好全部转化为硝酸溶液。则所用氧气在标准状况下的体积为_________L。
(3)向铝箔与混酸反应后的溶液中趁热加入一定质量的(NH4)2SO4,冷却后全部溶液正好转化为40.77 g铝铵矾晶体[化学式:NH4Al(SO4)2·12H2O,式量:453]。
①原铝箔中金属铝的质量为_________g。氧化膜的物质的量为___________mol。
②计算原混酸中硫酸的质量分数(保留三位小数,写出计算过程)。___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应2A ( g)+B(g)![]() 2C(g),若经2 s后测得C的浓度为0.6 mol· L-1,现有下列几种说法,其中正确的是 ( )
2C(g),若经2 s后测得C的浓度为0.6 mol· L-1,现有下列几种说法,其中正确的是 ( )
A.用物质A表示的反应的平均速率为0.3 mol·L-1·s-1
B.用物质B表示的反应的平均速率为0.6 mol·L-1·s-1
C.2 s时物质A的转化率为70%
D.2 s时物质B的浓度为0.7 mol · L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知元素周期表中共有18个纵行,下图实线表示元素周期表的边界。按核外电子排布,可把元素周期表里的元素划分为![]() 区、
区、![]() 区、
区、![]() 区、
区、![]() 区等。除
区等。除![]() 区外,其他区的名称来自按构造原理最后填入电子的能级的符号。
区外,其他区的名称来自按构造原理最后填入电子的能级的符号。
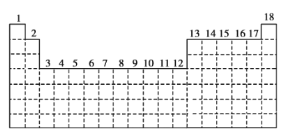
(1)请在上图中用实线画出![]() 区、
区、![]() 区、
区、![]() 区、
区、![]() 区的边界线,并分别用阴影
区的边界线,并分别用阴影![]() 和
和![]() 表示
表示![]() 区和
区和![]() 区________。
区________。
(2)有的同学受这种划分的启发,认为![]() 区内第6、7纵行的部分元素可以排在另一区,你认为应排在______区。
区内第6、7纵行的部分元素可以排在另一区,你认为应排在______区。
(3)请在上述元素周期表中用元素符号标出![]() 轨道处于半充满状态的元素________。
轨道处于半充满状态的元素________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究NO2、NO、SO2 、CO等大气污染气体的处理具有重要意义。NO2可用下列反应来处理:
6NO2(g)+8NH3(g) ![]() 7N2(g)+12H2O(g)+Q(Q>0)。
7N2(g)+12H2O(g)+Q(Q>0)。
(1)120℃时,该反应在一容积为2L的容器内反应,20min时达到平衡。10min时氧化产物比还原产物多了1.4g,则0~10min时,平均反应速率υ(NO2) = ____________________ ,电子转移了 ___________ 个。
(2)一定条件下上述反应在某体积固定的密闭容器中进行,能说明该反应已经达到平衡状态的是____________。
a.c(NO2):c(NH3) = 3:4 b.6v(NO2)正 = 7v(N2)逆
c.容器内气体总压强不再变化 d.容器内气体密度不再变化
(3)若保持其它条件不变,缩小反应容器的体积后达到新的平衡,此时NO2和N2的浓度之比_________ (填增大、不变、减小),NO2的转化率 ______________。
(4)一定条件下NO2与SO2可发生反应,方程式:NO2(g)+SO2(g)![]() SO3(g)+NO(g) Q。若反应的平衡常数K值变大,该反应___________(选填编号)。
SO3(g)+NO(g) Q。若反应的平衡常数K值变大,该反应___________(选填编号)。
a.一定向正反应方向移动 b. 平衡移动时,逆反应速率先减小后增大
c.一定向逆反应方向移动 d. 平衡移动时,正反应速率先增大后减小
(5)请写出用NaOH溶液完全吸收含等物质的量的NO、NO2混合气体的离子方程式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】十九大报告中提出要“打赢蓝天保卫战”,意味着对污染防治比过去要求更高。某种利用垃圾渗透液实现发电、环保二位一体结合的装置示意图如下,当该装置工作时,下列说法正确的是

A.盐桥中Cl-向Y极移动
B.电路中流过7.5 mol电子时,共产生标准状况下N2的体积为16.8L
C.电流由X极沿导线流向Y极
D.Y极发生的反应为2NO3-+10e-+6H2O===N2↑+12OH—,周围pH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于苯的叙述正确的是

A. 反应①为取代反应,有机产物与水混合浮在上层
B. 反应②为氧化反应,反应现象是火焰明亮并带有浓烟
C. 反应③为取代反应,有机产物是一种烃
D. 反应④中1 mol苯最多与3 mol H2发生加成反应,因为每个苯分子含有三个碳碳双键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M的名称是乙烯雌酚,它是一种激素类药物,结构简式如下。下列叙述不正确的是
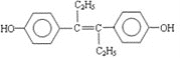
A.M属于芳香族化合物
B.M可与NaOH溶液或NaHCO3溶液发生反应
C.1molM最多能与7molH2发生加成反应
D.1molM与饱和溴水混合,最多消耗5molBr2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com