
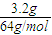 ×2=0.1mol�����������������ŵ磬��4OH-��O2��+2H2O+4e-����ת��0.1mol����ʱ�����������������Ϊ��
×2=0.1mol�����������������ŵ磬��4OH-��O2��+2H2O+4e-����ת��0.1mol����ʱ�����������������Ϊ��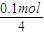 ×22.4L/mol=0.56L=560mL�����ٵ���������Ũ��Ϊ��
×22.4L/mol=0.56L=560mL�����ٵ���������Ũ��Ϊ�� =0.1mol/L�����Ե���������Ũ��Ϊ0.1mol/L����Һ��pHΪ1���ʴ�Ϊ��0.1��560��1��
=0.1mol/L�����Ե���������Ũ��Ϊ0.1mol/L����Һ��pHΪ1���ʴ�Ϊ��0.1��560��1��


| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ��ɽ��ʡ�����и���4�¹�����ѵ�����ۻ�ѧ�Ծ��������棩 ���ͣ�������
��Ԫ�صĻ����������������������Ź㷺��Ӧ�á�
��1��400�棬1.01�� Pa�£��ݻ�Ϊ1��0L���ܱ������г���0.5molSO2,
(g)��0.3 molO2 (g)��������Ӧ2SO2(g)��O2(g)
Pa�£��ݻ�Ϊ1��0L���ܱ������г���0.5molSO2,
(g)��0.3 molO2 (g)��������Ӧ2SO2(g)��O2(g) 2SO3(g)
��H����198kJ/mol����Ӧ��n(SO3)��n(O2)��ʱ��仯�Ĺ�ϵ����ͼ��ʾ
2SO3(g)
��H����198kJ/mol����Ӧ��n(SO3)��n(O2)��ʱ��仯�Ĺ�ϵ����ͼ��ʾ ����Ӧ��ƽ�ⳣ��K��_______��0��10 min����SO2��ʾ��ƽ����Ӧ����_________������ͼ����Ϣ���ж�������������ȷ����_____������ţ���
����Ӧ��ƽ�ⳣ��K��_______��0��10 min����SO2��ʾ��ƽ����Ӧ����_________������ͼ����Ϣ���ж�������������ȷ����_____������ţ���
A��a��ʱ�̵�����Ӧ���ʱ�b��ʱ�̵Ĵ�
B��c��ʱ�̷�Ӧ�ﵽƽ��״̬
C��d���e��ʱ�̵�c(O2)��ͬ
D����5 00�棬1.01��105Pa�£���Ӧ�ﵽƽ��ʱ��n( SO3) ��ͼ��e��ʱ�̵�ֵ��
��2����NaOH��Һ���չ�ҵ�����е�SO2��������Һʧȥ��������ʱ��25��ʱ�����Һ��pH=5.6����Һ��Na��,H��, HSO3��,SO32�����ӵ�Ũ���ɴ�С��˳����__________________��
��3����ͨ����ⷨʹ��2���е�����Һ������ѭ�����ã��缫��Ϊʯī�缫�����乤��ʾ��ͼ���£�

HSO3���������ҷ�Ӧ�ĵ缫��ӦʽΪ________________________�������ҵIJ���_________________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com