
 短周期元素甲~戊的原子序数依次增大,结合表中信息,回答有关问题.
短周期元素甲~戊的原子序数依次增大,结合表中信息,回答有关问题.| 甲 | 乙 | 丙 | 丁 | 戊 | |
| 主要化合价 | +1、-1 | +4、-4 | |||
| 性质或结构信息 | 同位素有3种 | 同素异形体有多种 | 2s22p4 | 五种原子中原子半径最大,未成对电子数为0 | 有两种常见氧化物,其中一种是大气污染物 |
分析 主族元素中,元素最高化合价与其族序数相同,其最低化合价=族序数-8,根据表中数据知,甲为H元素、乙为C元素、丙为O元素、丁为Mg元素、戊为S元素,
(1)乙为C元素,其最外层有4个电子,但未成对电子数是2,一种能级有一种电子云形状;
(2)同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,原子核外轨道中电子处于全满、全空、半满时原子较稳定;
(3)甲乙丙、甲丙戊组成的两种离子的钠盐分别是碳酸氢钠、硫酸氢钠,碳酸氢根离子和亚硫酸氢根离子能发生复分解反应,碳酸氢根离子和氢离子反应生成二氧化碳和水;
(4)乙、戊的最高价酸根离子分别是碳酸、硫酸,根据价层电子对互斥理论判断中心原子杂化方式;
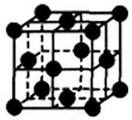
(5)铜为面心立方晶胞,铜原子配位数=3×8÷2;该晶胞中Cu原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,其密度=$\frac{\frac{M}{{N}_{A}}×4}{V}$.
解答 解:主族元素中,元素最高化合价与其族序数相同,其最低化合价=族序数-8,根据表中数据知,甲为H元素、乙为C元素、丙为O元素、丁为Mg元素、戊为S元素,
(1)乙为C元素,其最外层有4个电子,但未成对电子数是2,一种能级有一种电子云形状,所以该原子电子云形状有2种,故答案为:2;2;
(2)同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,原子核外轨道中电子处于全满、全空、半满时原子较稳定,Mg电子排布3s全满结构,第一电离能异常增大,所以其第一电离能大小顺序是Mg>Al>Na,故答案为:Mg>Al>Na;Mg电子排布3s全满结构,第一电离能异常增大;
(3)甲乙丙、甲丙戊组成的两种离子的钠盐分别是碳酸氢钠、硫酸氢钠,碳酸氢根离子和亚硫酸氢根离子能发生复分解反应,碳酸氢根离子和氢离子反应生成二氧化碳和水,离子方程式分别为HCO3-+HSO3-=H2O+CO2↑+SO32-、HCO3-+H+=H2O+CO2↑,
故答案为:HCO3-+HSO3-=H2O+CO2↑+SO32-;HCO3-+H+=H2O+CO2↑;
(4)乙、戊的最高价酸根离子分别是碳酸、硫酸,碳酸根离子中C原子价层电子对个数是3且不含孤电子对,硫酸根离子中S原子价层电子对个数是4且不含孤电子对,根据价层电子对互斥理论判断中心原子杂化方式分别为sp2、sp3,故答案为:sp2、sp3;
(5)铜为面心立方晶胞,铜原子配位数=3×8÷2=12;该晶胞中Cu原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,其密度=$\frac{\frac{M}{{N}_{A}}×4}{V}$=$\frac{\frac{64}{{N}_{A}}×4}{{a}^{3}}$g•cm-3=$\frac{256}{{a}^{3}{N}_{A}}$g•cm-3,
故答案为:12;$\frac{256}{{a}^{3}{N}_{A}}$.
点评 本题考查物质结构和性质,为高频考点,涉及晶胞计算、原子杂化方式判断、元素周期律等知识点,侧重考查学生分析计算及空间想象能力,难点是晶胞计算.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 非金属元素既可以形成阴离子,也可以形成阳离子 | |
| B. | 金属元素只能形成阳离子 | |
| C. | 分子式相同的物质化学性质相同 | |
| D. | 单核阳离子,其最外层均具有2电子或8电子的结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分类方法、统计方法、定量研究、实验方法和模型化方法等是化学研究的常用方法 | |
| B. | 电解熔融氧化铝、粗硅的制取、生物炼铜、煤焦油中提取苯等过程都涉及化学变化 | |
| C. | 从2016年1月1号开始浙江省汽油标准由“国Ⅳ”提高到“国V”,但这并不意味着汽车不再排放氮氧化物 | |
| D. | 纳米技术、分子设计技术的发展,将使分子晶体管、分子芯片、分子导线、分子计算机等化学器件得到广泛的应用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
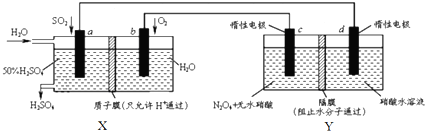
| A. | X是原电池,能够生产硫酸.Y是电解池,能够生产N2O5 | |
| B. | c电极的电极反应方程式为:N2O4+2HNO3-2e-=2N2O5+2H+ | |
| C. | 当电路中通过2mol e-,X、Y中各有1molH+从左边迁移到右边 | |
| D. | 为保证X中硫酸的质量分数不变,则加入的n(so2):n(H2O)=1:7.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 将浓氨水加到盛有AgCl固体的试管中 | AgCl固体完全溶解 | 所得溶液中c(Ag+)•c(Cl-) ≤Ksp(AgCl) |
| B | 向FeI2溶液中通入少量的氯气,再向反应后的溶液中滴加KSCN溶液 | 溶液变为红色 | Cl2能将Fe2+氧化成Fe3+ |
| C | 向固体纯碱中滴加足量浓盐酸,将产生的气体通入苯酚钠溶液 | 溶液变浑浊 | 酸性:盐酸>碳酸>苯酚 |
| D | 向两份蛋白质溶液中分别滴加饱和NaCl溶液和CuSO4溶液 | 均有固体析出 | 蛋白质均发生变性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非金属性:Y<X<W | |
| B. | 简单气态氢化物的热稳定性:Y<X | |
| C. | 化合物ZW、XY中化学键类型相同 | |
| D. | X、W的最高价氧化物的水化物均为强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
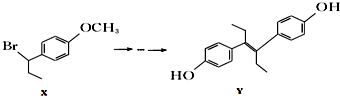
| A. | 化合物x中不含有手性碳原子 | |
| B. | 1mol化合物Y与浓溴水反应,最多消耗5mol Br2 | |
| C. | 在一定条件下化合物Y能发生加聚反应、缩聚反应 | |
| D. | 在氢氧化钠水溶液中加热,化合物X能发生消去反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳原子间都以单链相连的链烃是烷烃 | |
| B. | 所有糖类物质都有甜味 | |
| C. | 油与脂肪都属于甘油酯 | |
| D. | 葡萄糖与果糖互为同分异构体 |
查看答案和解析>>
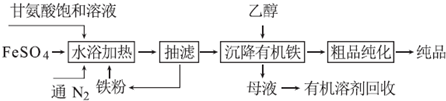
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com