
| A. | 自来水厂用含铁的化合物作净水剂 | |
| B. | 用丁达尔效应区分氢氧化铁胶体和氯化铁溶液 | |
| C. | 一束平行光照射蛋白质溶液时,从侧面要看到光亮的通路 | |
| D. | 在三氯化铁溶液中滴入氢氧化钠溶液出现红褐色沉淀 |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 抗酸药能中和胃里过多的盐酸,缓解胃部不适,是一类治疗胃痛的药 | |
| B. | 碳酸钙、氢氧化铝都能制成抗酸药 | |
| C. | 青霉素有阻止多种细菌生长的优异功能,虽经1×107 倍稀释,仍有疗效 | |
| D. | 中草药麻黄碱可用于治疗失眠、多梦等症状 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入足量镁粉的Fe2(SO)3溶液 | |
| B. | FeCl2溶液与稀硝酸混合后的溶液 | |
| C. | 铁丝在足量的氯气中燃烧后所得产物的溶液 | |
| D. | 长期暴露在空气中的绿矾溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

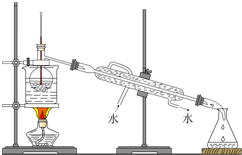
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
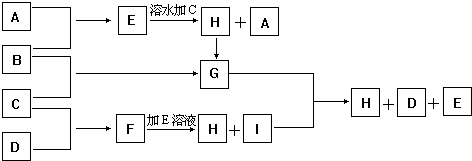
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22 mL、12 mL | B. | 13 mL、21 mL | C. | 16 mL、16 mL | D. | 21 mL、13 mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com