
| A. | 氯水保存在棕色剂瓶中,碘保存在配有铁盖的试剂瓶中 | |
| B. | 在配制和贮存FeCl3溶液时,要加入少量铁粉,以防在空气中变质 | |
| C. | 烧碱、纯碱等碱性溶液应保存在配有玻璃塞的试剂瓶中 | |
| D. | 漂白粉、烧碱、Na2SiO3均要密封保存 |
科目:高中化学 来源: 题型:解答题
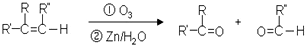
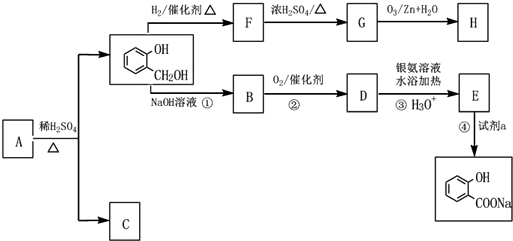
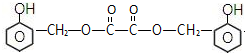 ,C俗称为草酸;
,C俗称为草酸;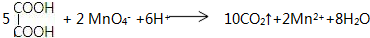 ; 写出C与对苯二甲醇在一定条件下发生缩聚反应的化学反应方程式:
; 写出C与对苯二甲醇在一定条件下发生缩聚反应的化学反应方程式: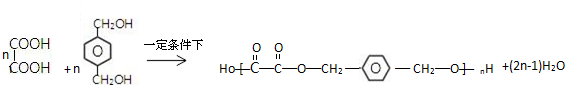 ;
; ;
; ;
;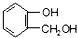 不能发生缩聚反应
不能发生缩聚反应 到F反应是否进行完全,可用FeCl3溶液检验
到F反应是否进行完全,可用FeCl3溶液检验 ;
;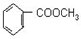 的最佳路线流程图(不参考答案能选用其他任何有机试剂,无机试剂任选). 流程图示例如下:
的最佳路线流程图(不参考答案能选用其他任何有机试剂,无机试剂任选). 流程图示例如下:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
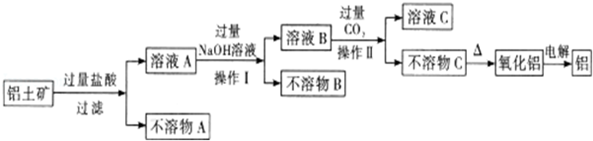
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| Ⅰ | Ⅱ | |
| A | 在淀粉KI试纸上滴几滴的FeCl3溶液,试纸变蓝 | 2Fe3++2I-=I2+2Fe2+ |
| B | 铝条置于火焰加热,看到铝熔化欲滴落,却又很快凝固 | 加热时,与O2发生反应,反应吸热 |
| C | 钠投到煤油和水的混合物中,钠粒在分界处作跳动和游动 | 钠的密度比水小比煤油大,能与水反应产生H2 |
| D | 一试管内有2V的Cl2,倒置于水中,在强光充分照射,最后试管中气体变为无色,体积为V | 因为反应Cl2+H2O?HCl+HClO 和2HClO$\stackrel{光照}{?}$2HCl+O2↑ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
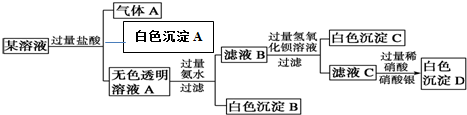
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COCH3 | B. | CH3CH2CHO | C. | CH3CH(OH)CH3 | D. | CH3CH2COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
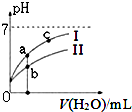 “8.12”天津港爆炸中有一定量的氰化物泄露.氰化物多数易溶于水,有剧毒,易造成水污染.为了增加对氰化物的了解,同学们查找资料进行学习和探究.
“8.12”天津港爆炸中有一定量的氰化物泄露.氰化物多数易溶于水,有剧毒,易造成水污染.为了增加对氰化物的了解,同学们查找资料进行学习和探究.| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数( 25℃) | Ka=1.77×10-4 | Ka=5.0×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
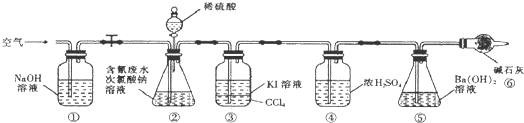
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com