
 氨在国民经济中占有重要地位.
氨在国民经济中占有重要地位.分析 I.(1)根据热化学方程式的书写规则再写出热化学方程式;
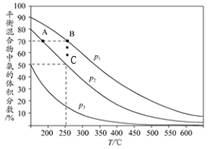
(2)①合成氨反应为气体体积减小的反应,则压强越大平衡越向正向移动,平衡混合物中氨的体积分数越大,据此分析;
②根据温度越高,反应速率越快分析;化学平衡常数只与温度有关;由图象知C点氨气的体积分数为50%结合三组量法计算氮气的转化率;
③A.断开1个N≡N键的同时有6个N-H键形成,均表示正反应速率;
B.混合气的平均相对分子质量是混合气的质量和混合气的总的物质的量的比值,质量不变,但物质的量是变化的,所以混合气体的平均相对分子质量为不停变化的;
C.根据△G=△H-T△S<0能自发进行判断;
D.增大n(N2):n(H2)的比值,相当于增大氮气浓度;
II.氨气为碱性气体,易与酸反应,应用碱性电解质,负极发生氧化反应.
解答 解:(1)每反应1mol N2,放出92.2kJ热量,则反应的热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ/mol;
故答案为:N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ/mol;
(3)①合成氨反应为气体体积减小的反应,则压强越大平衡越向正向移动,平衡混合物中氨的体积分数越大,所以p1、p2、p3的大小关系为p1>p2>p3,故答案为:p1>p2>p3;压强越大平衡越向正向移动,平衡混合物中氨的体积分数越大;
②温度越高,反应速率越快,所以A、B点生成氨气的速率大小关系为vA<vB;化学平衡常数只与温度有关,B、C点温度相同,则化学平衡常数大小关系为KB=Kc;由图象知C点氨气的体积分数为50%,则
N2+3H2?2NH3
开始 1 3 0
转化 x 3x 2x
平衡 1-x 3-3x 2x
所以$\frac{2x}{4-2x}$=50%,解得x=$\frac{2}{3}$,则氢气的转化率为$\frac{3×\frac{2}{3}}{3}$×100%=66.7%,故答案为:vA<vB;KB=Kc;66.7%;
③A.断开1个N≡N键的同时有6个N-H键形成,均表示正反应速率,反应不一定达到平衡状态,故A错误;
B.混合气的平均相对分子质量是混合气的质量和混合气的总的物质的量的比值,质量不变,但物质的量是变化的,所以混合气体的平均相对分子质量不再改变状态,反应一定达到平衡状态,故B正确;
C.由于△H<0、△S<0,根据△G=△H-T△S可知合成氨反应在低温下能自发进行,故C错误;
D.增大n(N2):n(H2)的比值,相当于增大氮气浓度,有利用提离H2的转化率,故D正确;
故选:BD;
II.氨气为碱性气体,易与酸反应,所以电解质溶液应呈碱性,负极发生氧化反应,氨气被氧化生产氮气,电极反应式为2NH3-6e-+6OH-=N2+6H2O;设消耗氨气是xmol,则3x×80%×NA=3600/1.6×10-19,解得x=3600/(1.6×10-19NA×3×80%).
故答案为:碱性;2NH3-6e-+6OH-═N2+6H2O;3600/(1.6×10-19NA×3×80%).
点评 本题考查化学平衡、电化学等知识,题目难度中等,把握电极反应式的书写,注重学生能力的训练,把握图象及数据处理即可解答.


科目:高中化学 来源: 题型:选择题

| A. | 氨可用作制冷剂 | |
| B. | 铵态氮肥一般不能与碱性化肥混合使用 | |
| C. | 硝酸可用于制化肥、农药、炸药、染料、盐类等 | |
| D. | 某浓硝酸中含有溶质2 mol,标准状况下,该浓硝酸与足量的铜完全反应能生成1 mol NO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 工业上通常用工业酒精和生石灰混合蒸馏法制取无水乙醇.如图是实验室中模拟工业原理制取无水乙醇的装置.
工业上通常用工业酒精和生石灰混合蒸馏法制取无水乙醇.如图是实验室中模拟工业原理制取无水乙醇的装置.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在一定条件下,反应A2+B2?2AB;△H=QkJ/mol的反应时间与生成物AB的质量分数(AB%)的关系如图所示,其中a、b为不同温度时的反应曲线(其他条件不变),c为在t3时刻开始缩小容器容积(温度不变)的变化曲线.下列有关说法正确的是( )
在一定条件下,反应A2+B2?2AB;△H=QkJ/mol的反应时间与生成物AB的质量分数(AB%)的关系如图所示,其中a、b为不同温度时的反应曲线(其他条件不变),c为在t3时刻开始缩小容器容积(温度不变)的变化曲线.下列有关说法正确的是( )| A. | △H>0 | B. | AB一定是气体物质 | ||
| C. | 反应温度a低于b | D. | A2、B2中最少有一种是气态物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “梨花淡自柳深青,柳絮飞时花满城”中柳絮的主要成分和棉花的相同 | |
| B. | 制作烟花的过程中常加入金属发光剂和发色剂使烟花放出五彩缤纷的颜色 | |
| C. | 草莓棚中使用的“吊袋式二氧化碳气肥”的主要成分可以是碳酸钙 | |
| D. | 芒硝晶体(Na2SO4•10H2O)白天在阳光下曝晒后失水、溶解吸热,晚上重新结晶放热,实现了太阳能转化为化学能继而转化为热能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室制取蒸馏水的装置中,冷水从冷凝管的上口进,下口出 | |
| B. | 实验结束后,用嘴吹熄酒精灯 | |
| C. | 皮肤上不慎沾上NaOH溶液,立即用盐酸冲洗 | |
| D. | 稀释浓硫酸时,将浓硫酸沿器壁慢慢注入水中,并不断搅拌 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子键就是使阴、阳离子结合成化合物的静电吸引力 | |
| B. | 非金属间只能形成共价键 | |
| C. | 因为离子键是一种强相互所用,所以离子化合物均很难分解 | |
| D. | 含有离子键的化合物一定是离子化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com