
【题目】火法炼铜首先要焙烧黄铜矿,其反应为:2CuFeS2+O2===Cu2S+2FeS+SO2。下列说法正确的是( )
A. 每生成1 molCu2S,有4 mol硫被氧化 B. CuFeS2仅作还原剂,硫元素被氧化
C. 每转移1.2 mol电子,有0.2mol硫被氧化 D. SO2是还原产物
科目:高中化学 来源: 题型:
【题目】反应mA(s)+nB(g)![]() pC(g) △H<0,在一定温度下,平衡时B的体积分数与压强变化的关系如图所示,则下列叙述正确的是( )
pC(g) △H<0,在一定温度下,平衡时B的体积分数与压强变化的关系如图所示,则下列叙述正确的是( )

①m+n<p ②x点的状态是v正>v逆 ③n>p ④x点比y点的反应速度慢 ⑤若升高温度,该反应的平衡常数增大
A. ①②④ B. ②④
C. ③⑤ D. ①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L容积不变的容器中,发生N2+3H2 ![]() 2NH3的反应。现通入4 mol H2和4 mol N2,10 s内用H2表示的反应速率为0.12 mol/(L·s),则10 s后容器中N2的物质的量是
2NH3的反应。现通入4 mol H2和4 mol N2,10 s内用H2表示的反应速率为0.12 mol/(L·s),则10 s后容器中N2的物质的量是
A. 1.6 mol B. 2.8 mol
C. 3.2 mol D. 3.6 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,有pH=3的盐酸、硫酸、醋酸(假设CH3COOH的电离度为1%)三种相同体积的溶液。以下叙述错误的是
A. 测定其导电性能相同
B. 与足量的锌粉反应的起始速率相同
C. 与足量的锌粉反应产生氢气的体积比为1∶1∶100
D. 与同浓度氢氧化钠溶液反应,消耗氢氧化钠溶液的体积为1∶2∶100
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸锶(SrSO4)在水中的沉淀溶解平衡曲线如图所示。 下列说法正确的是

A. 283K时,图中a点对应的溶液是不饱和溶液
B. 温度一定时,Ksp(SrSO4) 随c(SO42-) 的增大而减小
C. 283K下的SrSO4饱和溶液升温到363K后变为不饱和溶液
D. 三个不同温度中,363K时Ksp(SrSO4)最大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在好氧菌和厌氧菌作用下废液中NH4+能转化为N2(g)和H2O(l),示意图如下:

反应I:NH4+(aq)+2O2(g)=NO3-(aq)+2H+(aq)+H2O(l) ΔH1=a kJ·mol-1
反应II:5NH4+(aq)+3NO3-(aq)=4N2(g)+9H2O(l)+2H+(aq) ΔH2=b kJ·mol-1
下列说法正确的是
A. 两池发生的反应中氮元素只被氧化
B. 两池中投放的废液体积相等时NH4+能完全转化为N2
C. 常温常压下,反应II中生成22.4 L N2转移的电子数为3.75×6.02×1023
D. 4NH4+(aq)+3O2(g)=2N2(g)+4H+(aq)+6H2O(l) ΔH=![]() (3a+b) kJ·mol-1
(3a+b) kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,在体积为2L的恒容密闭容器中,某一反应中X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列表述中正确的是
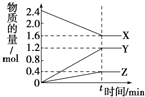
A. 反应的化学方程式为3X![]() 3Y+Z
3Y+Z
B. t时,正、逆反应都不再继续进行,反应达到化学平衡
C. 若t=4,则0~t的X的化学反应速率为0.1mol/(Lmin)
D. 温度、体积不变,t时刻充入1 mol He使压强增大,正、逆反应速率都增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种天然气臭味添加剂的绿色合成方法为:CH3CH2CH=CH2+H2S ![]() CH3CH2CH2CH2SH。下列反应的原子利用率与上述反应相近的是
CH3CH2CH2CH2SH。下列反应的原子利用率与上述反应相近的是
A. 乙烯与水反应制备乙醇
B. 苯和硝酸反应制备硝基苯
C. 乙酸与乙醇反应制备乙酸乙酯
D. 甲烷与Cl2反应制备一氯甲烷
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com