
 氢的存储是氢能应用的主要瓶颈,目前所采用或正在研究的主要储氢材料有:配位氢化物、富氢载体化合物、碳质材料、金属氢化物等.
氢的存储是氢能应用的主要瓶颈,目前所采用或正在研究的主要储氢材料有:配位氢化物、富氢载体化合物、碳质材料、金属氢化物等.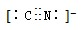
| m |
| ρ |
| 1 |
| 2 |
 ,故正确;
,故正确;| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 8 |
| 1 |
| 2 |
| m |
| ρ |
| ||
| a |
| 52 |
| a?NA |
| 52 |
| a?NA |


科目:高中化学 来源: 题型:
 如图是某有机物分子的比例模型,黑色的是碳原子,白色的是氢原子,灰色的是氧原子.关于该物质说法不正确为( )
如图是某有机物分子的比例模型,黑色的是碳原子,白色的是氢原子,灰色的是氧原子.关于该物质说法不正确为( )| A、不能使紫色石蕊变红 |
| B、与碳酸钠反应 |
| C、能发生酯化反应 |
| D、能发生氧化反应催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溴苯和水,酒精和水 |
| B、四氯化碳和水,溴苯和己烷 |
| C、豆油和水,苯和溴苯 |
| D、汽油和水,己烷和水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素.
甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素.| 序号 | A溶液 | B溶液 |
| ① | 2mL 0.1mol/L H2C2O4溶液 | 4mL 0.01mol/L KMnO4溶液 |
| ② | 2mL 0.2mol/L H2C2O4溶液 | 4mL 0.01mol/L KMnO4溶液 |
| ③ | 2mL 0.2mol/L H2C2O4溶液 | 4mL 0.01mol/L KMnO4溶液和少量MnSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素代号 | I1 | I2 | I3 | I4 |
| Q | 2 080 | 4 000 | 6 100 | 9 400 |
| R | 496 | 4 562 | 6 912 | 9 543 |
| S | 738 | 1 451 | 7 733 | 10 540 |
| T | 578 | 1 817 | 2 745 | 11 575 |
| U | 420 | 3 100 | 4 400 | 5 900 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com