
【题目】X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示。若Y原子的L层电子数是K层电子数的3倍,下列说法不正确的是
![]()
A. Y的气态氢化物比X的稳定B. W的最高价氧化物对应水化物的酸性比Z的强
C. Y的非金属性比Z的强D. X与Y形成的化合物都易溶于水
【答案】D
【解析】
X、Y、Z、W均为短周期元素,由图可知X、Y在第二周期,Y原子的L层电子数是K层电子数的3倍,即K层电子为2,L层为6,其质子数为8,则Y为氧元素,由元素在周期表中的位置可知X为氮元素,Z为硫元素,W为氯元素,据此分析判断。
根据以上分析可知X、Y、Z、W分别是N、O、S、Cl。则
A、同周期从左到右元素的非金属性增强,则非金属性Y>X,所以Y的气态氢化物比X的稳定,故A正确;
B、同周期从左到右元素的非金属性增强,则非金属性W>Z,所以W的最高价氧化物对应水化物的酸性比Z的强,故B正确;
C、同主族元素从上到下非金属性减弱,则非金属性Y>Z,故C正确;
D、X与Y形成的化合物NO不溶于水,故D错误;
故答案选D。


科目:高中化学 来源: 题型:
【题目】已知2A2(g)+B2(g)![]() 2C3(g)△H=-akJ·mol-1(a>0) ,在一个有催化剂、固定容积的容器中加入2molA2和1molB2,在500℃时充分反应达到平衡后
2C3(g)△H=-akJ·mol-1(a>0) ,在一个有催化剂、固定容积的容器中加入2molA2和1molB2,在500℃时充分反应达到平衡后![]() 的浓度为xmol·L-1,放出热量bkJ。请回答下列问题:
的浓度为xmol·L-1,放出热量bkJ。请回答下列问题:
(1) a__________(填“>”、“=”或“ <”) b。
(2)下表为不同温度下反应的平衡常数。由此可推知,表中T1__________(填“ >”、“ < ”或“ =”) T2。
|
|
|
|
|
|
|
|
若在原来的容器中,只加入2molC3,500℃时充分反应达到平衡后,吸收热量ckJ,则C3的浓度__________(填“>”、“=” 或“ <”) xmol·L-1,a、b、c之间满足何种关系?__________(用代数式表示)。
(3)在相同条件下要想得到2akJ热量,加入各物质的物质的量可能是__________(填字母)。
A.4molA2和2molB2 B.4molA2、2molB2和2molC3
C.4molA2和4molB2 D.6molA2和4molB2
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是__________(填字母)。
A.及时分离出C3气体 B.适当升高温度
C.增大B2的浓度 D.选择高效的催化剂
(5)若将上述容器改为恒压容器(反应前体积相同),起始时加入2molA2和1molB2,500℃时充分反应达到平衡后,放出热量dkJ,则d__________(填“>”、“=” 或“ <”) b,理由是__________。
(6)在一定温度下,在一个容积不变的容器中通入2molA2和1molB2及适量固体催化剂,使反应达到平衡。保持同一反应温度,在相同容器中,将起始物质改为4molA2和2molB2,则平衡时A2的转化率__________(填span>“不变”、“变大”、“变小”或“不能确定”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求完成下列化学方程式或离子方程式。
(1)利用铝热反应焊接钢轨的化学方程式为_________________________。
(2)工业制备粗硅的化学方程式_________________。
(3)氯化铝溶液与氨水制备氢氧化铝的离子方程式为_________________。
(4)用离子反应方程式说明为何装氢氧化钠溶液不能用玻璃塞_________________。
(5)用盐酸除去铜锈(碱式碳酸铜)的离子反应_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素X的原子有3个电子层,最外层有4个电子。则元素X位于周期表的( )
A. 第四周期ⅢA族 B. 第四周期ⅢB族
C. 第三周期IV B族 D. 第三周期ⅣA族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)铝土矿(主要成分为Al2O3,还含有SiO2、Fe2O3)是工业上制备氧化铝的主要原料。工业上提取氧化铝的工艺流程如下:
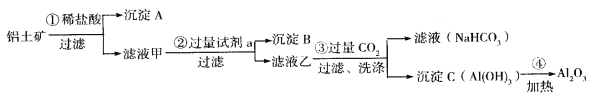
①沉淀A成分是____________;步骤②中的试剂a是_________;(以上均填化学式)。
②简述检验所得滤液甲中存在Fe3+的操作方法:________________________。
(2)用含少量铁的氧化铜制取氯化铜晶体(CuCl2·xH2O)。有如下操作:

已知:在pH为4~5时,Fe3+几乎完全转化为Fe(OH)3沉淀,Cu2+却不反应。
①氧化剂A可选用_________________(填编号,下同)。
A KMnO4 B HNO3 C Cl2 D 浓盐酸
②试剂B可选用____________________。
A NaOH B CuO C FeO D HCl
③试剂B的作用是_______________________________。
A 使Cu2+完全沉淀 B 使Fe3+完全沉淀 C 提高溶液的pH D 除去过量的氧化剂
④从滤液经过结晶得到氯化铜晶体的方法是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸是二元中强酸,草酸氢钠溶液显酸性。常温下,向10 mL 0.01 mol/L NaHC2O4溶液中滴加0.01 mol/L NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是
A. V(NaOH)="=" 0时,c(W)="=" 1 × 10-2mol/L
B. V(NaOH)< 10 mL时,不可能存在c(Na+)="=" 2 c(C2O![]() )+ c(HC2O
)+ c(HC2O![]() )
)
C. V(NaOH)="=" 10 mL时,c(W)="=" 1 × 10-7mol/L
D. V(NaOH)> 10 mL时,c(Na+)> c(C2O![]() )>c(HC2O
)>c(HC2O![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于共价键的说法正确的是 ( )
A.金属原子在化学反应中只能失去电子,因而不能形成共价键
B.由共价键形成的分子可以是单质分子,也可以是化合物分子
C.共价键只能在不同原子之间形成
D.稀有气体分子中只存在共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. 钠的金属性比锂强 B. 碘的非金属性比氯弱
C. ⅤA族中原子半径最小的是氮 D. 第三周期中,金属性最强的是铝
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com