
下列说法错误的是
A. 用新制的氢氧化铜不能区分乙醇,乙酸
B. (CH3)2CHCH(CH3)2的名称是2,3-二甲基丁烷
C. 近日,南充周边地市发生人感染H7N9禽流感病毒病例,该病毒可被高温和紫外线杀灭,利用了蛋白质变性的原理
D. CH4和C10H22互为同系物
科目:高中化学 来源:2016-2017学年四川省成都简阳市高二上学期期末检测化学试卷(解析版) 题型:实验题
影响化学反应速率的因素很多,某课外兴趣小组用实验方法进行探究。
(1)取等物质的量浓度、等体积的H2O2溶液分别进行H2O2的分解实验,实验报告如下表所示(现象和结论略)。
序号 | 温度/℃ | 催化剂 | 现象 | 结论 |
1 | 40 | FeCl3溶液 | ||
2 | 20 | FeCl3溶液 | ||
3 | 20 | MnO2 | ||
4 | 20 | 无 |
①实验1、2研究的是________________对H2O2分解速率的影响。
②实验2、3的目的是_______________。
(2)查文献可知,Cu2+对H2O2分解也有催化作用,为比较Fe3+、Cu2+对H2O2分解的催化效果,该小组的同学分别设计了如图甲、乙所示的实验。回答相关问题:
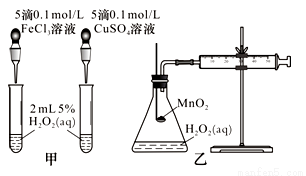
①定性分析:如图甲可通过观察________________,定性比较得出结论。有同学提出将CuSO4溶液改为CuCl2溶液更合理,其理由是_______________。
②定量分析:如图乙所示,实验时以收集到40 mL气体为准,忽略其他可能影响实验的因素,实验中需要测量的数据是_____________。
(3)酸性高锰酸钾溶液和草酸溶液可发生反应:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,实验时发现开始反应速率较慢,溶液褪色不明显,但一段时间后突然褪色,反应速率明显加快。对此展开讨论:
①某同学认为KMnO4与H2C2O4的反应是 热反应,导致_______________;
②从影响化学反应速率的因素看,你认为还可能是____________________的影响。要证明你的猜想,实验方案是 。
查看答案和解析>>
科目:高中化学 来源:山东省2016-2017学年高一3月月考化学试卷 题型:选择题
下列反应的离子方程式书写正确的是( )
A. 铝片放入氧氧化钠溶液中:Al+2OH-+6H2O=2[A1(OH)4]- +3H2↑
B. Na与水反应:Na+2H2O=Na++ H2↑+2OH-
C. 向A1C13溶液中加入过量NaOH溶液:Al3++3OH-=Al(OH)3↓
D. A1C13溶液中滴入过量的氨水:Al3++3OH-=Al(OH)3↓
查看答案和解析>>
科目:高中化学 来源:2017届陕西省咸阳市高三二模理综化学试卷(解析版) 题型:选择题
下列有关说法正确的是
A. 分子式为C5H12O的有机物,分子中含有2个甲基的同分异构体有4种
B. 乙烷、苯、氯乙烯等三种有机化合物分子内所有原子均在同一平面上
C. 由乙酸和乙醇制乙酸乙酯的反应及油脂的水解反应均属于取代反应
D. 乙烯和苯都能使溴水褪色,且褪色的原理相同
查看答案和解析>>
科目:高中化学 来源:2017届四川省南充市高三第二次高考适应性考试理综化学试卷(解析版) 题型:选择题
室温下,向H2C2O4溶液中逐滴加入NaOH溶液,所得溶液中H2C2O4,HC2O4-,C2O42-三者物质的量分数(分布系数)随pH变化的关系入左图所示。右图为不同浓度NaHC2O4溶液中部分微粒浓度。下列表述错误的是
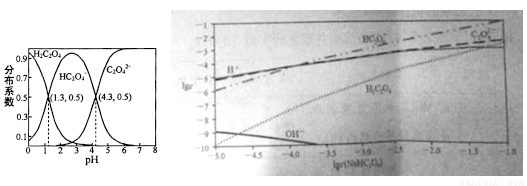
A. HC2O4- H++C2O42- K=1×10-4.3
H++C2O42- K=1×10-4.3
B. 将等物质的量的NaHC2O4、Na2C2O4溶于水中,所得溶液pH恰好为4.3
C. NaHC2O4溶液中一定存在c(C2O42-)>c(H2C2O4),同时c(H+)>c(OH-)
D. 在0.1mol/L NaHC2O4溶液中各离子浓度大小关系为:c(Na+)>c(HC2O4-)>c(C2O42-)>c(H2C2O4)> c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源:2017届江苏省南京市、盐城市高三第二次模拟考试化学试卷(解析版) 题型:实验题
溴化钙晶体(CaBr2·2H2O)为白色固体,易溶于水,可用于制造灭火剂、制冷剂等。一种制备溴化钙晶体的工艺流程如下:
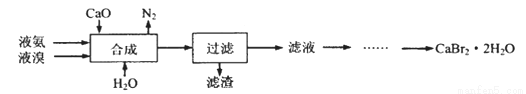
(1)实验室模拟海水提溴的过程中,用苯萃取溶液中的溴,分离溴的苯溶液与水层的操作是(装置如下图):使玻璃塞上的凹槽对准漏斗上的小孔,将活塞拧开,使下面的水层慢慢流下,待有机层和水层界面与活塞上口相切即关闭活塞,______________。
(2)“合成”的化学方程式为___________________。 “合成”温度控制在70℃以下,其原因是__________。投料时控制n(Br2):n(NH3)= 1:0.8,其目的是__________________。
(3)“滤渣”的主要成分为_________________(填化学式)。
(4)“滤液”呈强碱性,其中含有少量BrO-、BrO3-,请补充从“滤液”中提取CaBr2·2H2O的实验操作:加热驱除多余的氨,______________。[实验中须使用的试剂有:氢溴酸、活性炭、乙醇;除常用仪器外须使用的仪器有:砂芯漏斗,真空干燥箱]
查看答案和解析>>
科目:高中化学 来源:2017届江苏省南京市、盐城市高三第二次模拟考试化学试卷(解析版) 题型:选择题
下图所示与对应叙述相符的是
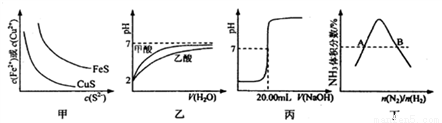
A. 图甲表示一定温度下FeS和CuS的沉淀溶解平衡曲线,则Ksp(FeS)>Ksp(CuS)
B. 图乙表示pH=2的甲酸与乙酸溶液稀释时的pH变化曲线,则酸性:甲酸<乙酸
C. 图丙表示用0.1000 mol·L-lNaOH溶液滴定25.00 mL盐酸的滴定曲线,则 c(HCl)=0.0800 mol ·L-1
D. 图丁表示反应N2(g)+3H2(g)  2NH3(g)平衡时NH3体积分数随起始n(N2)/n(H2)变化的曲线,则转化率:αA(H2)=αB(H2)
2NH3(g)平衡时NH3体积分数随起始n(N2)/n(H2)变化的曲线,则转化率:αA(H2)=αB(H2)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省高二3月月考化学试卷(解析版) 题型:选择题
某石油化工产品X的转化关系如下图,下列判断正确的是( )
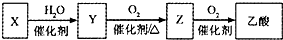
A. 0.1 mol·L-1乙酸溶液pH为1 B. 1 mol Y与足量金属钠反应,能生成3 mol H2
C. Z与CH3OCH3互为同分异构体 D. Z可通过加成反应生成Y
查看答案和解析>>
科目:高中化学 来源:2017届北京市海淀区高三3月适应性考试(零模)理综化学试卷(解析版) 题型:简答题
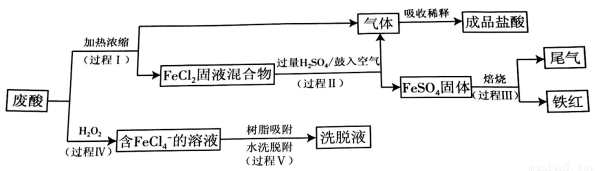
电力工业所需的钢制构件在镀锌前需要经过酸洗,其基本原理是用盐酸除去其表面的Fe2O3·H2O及FeO等杂质。回收废酸同时生产含铁产品的流程如下:
已知:i.酸洗钢制构件后得到废酸的主要成分如下表所示。
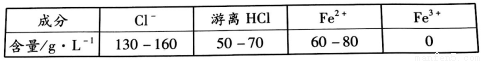
ii pH <4时,Fe2+不易被氧气氧化。
(1)酸洗钢制构件时发生反应的离子方程式:2H++ FeO=Fe2++H2O、_______________。
(2)过程II中,发生的主要反应:FeCl2(s)十H2SO4(aq)  FeSO4(s)+2HCl( aq)。
FeSO4(s)+2HCl( aq)。
①加入过量H2SO4的作用是_____________(至少写出两点)。
②用化学平衡原理解释鼓入空气的目的:_____________。
(3)过程III中,FeSO4隔绝空气焙烧得到的尾气中含有两种可用于生产硫酸的氧化物,此过程发生反应的化学方程式是_________________。
(4)过程IV发生反应的离子方程式是____________________。
(5)过程V:阴离子交换树脂可将FeCl4-选择性吸附分离,其过程可表示为ROH +X-  RX +OH-。当树脂吸附饱和后可直接用水洗涤树脂进行脱附,同时脱附过程发生反应:FeCl4-
RX +OH-。当树脂吸附饱和后可直接用水洗涤树脂进行脱附,同时脱附过程发生反应:FeCl4-  Fe3+ +4C1-。
Fe3+ +4C1-。
①吸附后溶液酸性下降的原因是_______________。
②洗脱液中主要含有的溶质是______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com