
【题目】下列表示式错误的是( )
A. Na+的轨道表示式: 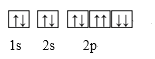
B. Na+的结构示意图:![]()
C. Na的电子排布式:1s22s22p63s1
D. Na的简化电子排布式:[Ne]3s1
【答案】A
【解析】
钠原子的电子排布式为1s22s22p63s1,或写为[Ne]3s1,Na+的原子核内有11个质子,核外有10个电子,Na为金属元素,易失去电子,所以其价电子排布式为:3s1,轨道表示式用箭头“↑”或“↓”来区别自旋方向的不同电子,根据泡利原理可知,每个轨道最多容纳2个电子且自旋方向相反,据此分析解答。
A. 轨道表示式用一个方框或圆圈表示能级中的轨道,用箭头“↑”或“↓”来区别自旋方向的不同电子,每个轨道最多容纳2个电子,2个电子处于同一轨道内,且自旋方向相反,所以Na+的轨道表示式:![]() ,A项错误;
,A项错误;
B.Na+的原子核内有11个质子,核外有10个电子,结构示意图为![]() ,B项正确;
,B项正确;
C. 钠原子的电子排布式为1s22s22p63s1,或写为[Ne]3s1,C项正确;
D. 钠原子的简化电子排布式为[Ne]3s1,D项正确;
答案选A。


科目:高中化学 来源: 题型:
【题目】NO2是形成雾霾天气的原因之一。
(1)重型车辆常在排气管内“喷淋”尿素[CO(NH2)2]溶液,使NO2转化为无污染物质。采用“喷淋”时,该反应的活化能____(选填“增大”“减小”“不变”),写出该反应的化学方程式:____。(已知:CO(NH2)2中N呈-3价)
(2)以CO2与NH3为原料可合成化肥尿素。已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s) ΔH=-l59.5 kJ·mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(l) ΔH=-160.5 kJ·mol-1
③H2O(l)=H2O(g) ΔH=+44.0 kJ·mol-1
写出CO2与NH3合成尿素和气态水的热化学反应方程式______。
(3)恒温下将1.6molNH3和0.8molCO2放入容积为8L的恒容密闭容器中,反应生成NH2CO2NH4(s),下列各项能说明反应达到平衡状态的是______。
a.容器内气体压强保持不变 b.CO2与NH3的速率之比为1∶2
c.NH2CO2NH4(s)质量保持不变 d.容器内温度保持不变
该反应达到平衡时,测得CO2的物质的量浓度为0.05mol·L-1。则平衡时CO2的转化率α=____;若其他条件不变,移去少量NH2CO2NH4,CO2的转化率_____(选填“增大”“减小”“不变”)。
(4)为减少NO2排放,可将NO2转化为NO后通入如图所示装置,同时补充气体物质A使NO全部转化为NH4NO3,该装置中总化学反应方程式是_____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中,所选装置或实验设计合理的是
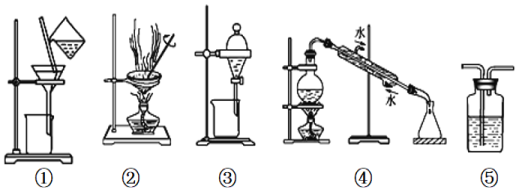
A. 用图①和②所示装置可以除去Na2CO3中的CaCO3杂质,并获得Na2CO3固体
B. 用乙醇提取溴水中的溴选择图③所示装置
C. 用图④所示装置可以分离乙醇水溶液
D. 图⑤所示装置中盛有饱和Na2CO3溶液除去CO2中含有的少量HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表代表周期表中的几种短周期元素,下列说法中错误的是
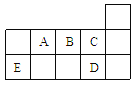
A. ED4分子中各原子均达8电子结构
B. AD3和ED4两分子的中心原子均为sp3杂化
C. A、B、C第一电离能的大小顺序为C>B>A
D. C、D气态氢化物稳定性强弱和沸点高低均为C>D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于在一个密闭容器中进行的反应C(s)+H2O(g) ![]() CO(g)+H2(g) ,下列条件的改变对反应速率几乎没有影响的是
CO(g)+H2(g) ,下列条件的改变对反应速率几乎没有影响的是
①增加C的量; ②增加CO的量;
③将容器的体积缩小一半; ④保持体积不变,充入N2以增大压强;
⑤升高反应体系的温度; ⑥保持压强不变,充入N2以增大体积。
A. ②③ B. ①④ C. ①⑥ D. ④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关分散系的叙述中不正确的是( )
A.胶体分散质粒子较大,不能透过滤纸
B.分散系根据分散质粒子大小分为溶液、胶体和浊液三类
C.利用丁达尔效应可以区分溶液和胶体
D.将纳米材料![]() 微粒直径是1nm-100nm)分散到液体分散剂中的分散系属于胶体
微粒直径是1nm-100nm)分散到液体分散剂中的分散系属于胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出砷的元素符号____________,原子中所有电子占有______个轨道,核外共有________个不同运动状态的电子。
(2)写出Ni的元素名称________,该元素在周期表的位置为第____周期,第____族。
(3)第四周期基态原子中未成对电子数最多的元素是_________,该元素基态原子的价电子轨道表示式为________________。
(4)第三电子层上有____个能级,作为内层最多可容纳___个电子,作为最外层时,最多可含有__个未成对电子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组表述中,正确的是
A. 区分晶体和非晶体最可靠的科学方法是对固体进行 X射线衍射
B. 离子键、金属键无方向性和饱和性,而所有共价键都有方向性和饱和性
C. 处于能量最低状态时,外围电子排布为4d15s2的某元素原子,M能层共有8个电子,该元素位于![]() 区第ⅢB族
区第ⅢB族
D. 对充有氖气的霓虹灯管通电,灯管发出红色光.产生这一现象的主要原因是电子由基态向激发态跃迁时以光的形式释放能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室模拟工业漂白液(有效成分为NaClO)脱除废水中氨氮(NH3)的流程如下:
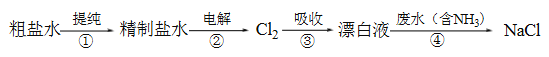
下列分析正确的是
A. ①中采用蒸馏的方法精制粗盐水
B. ②中阳极的主要电极反应:4OH- - 4e- = 2H2O + O2↑
C. ③中制备漂白液的反应:Cl2 + OH- = Cl- + HClO
D. ②、③、④中均发生了氧化还原反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com