
【题目】分类是学习的一种重要方法,“价一类”二维图对学习化学知识具有重要的指导意义。物质的化学反应常与外界条件密切相关。回答下列问题:
(1)含有同一元素的X、Y、Z、E、M五种物质,一定条件下有以下的转化关系。
![]()
①若E为红棕色气体,则该气体的收集方法为___;X分子含有10个电子,则气体X水溶液中离子有___。
②若Y为淡黄色固体单质,写出Z→E的化学反应方程式___。
(2)盐酸、硫酸、硝酸是工业生产中常用的三种强酸。
①盐酸既有酸性,又能表现氧化性和还原性,其还原产物是___;若足量的MnO2与100mL12mol·L-1的浓盐酸反应,生成Cl2的物质的量___0.3mol(填:“大于”、“等于”、“小于”)。
②足量的锌与浓硫酸反应,反应开始时的化学方程式为___;反应快结束时的离子反应方程式为___。
③将6.4g铜与足量的浓硝酸反应,产生NO和NO2气体的体积为2.24L(STP),则参加反应的硝酸的物质的量为___。
【答案】向上排空气法 OH-、NH4+、H+ 2SO2+O2![]() 2SO3 H2 小于 Zn+2H2SO4(浓)ZnSO4+SO2↑+2H2O Zn+2H+Zn2++H2↑ 0.3 mol
2SO3 H2 小于 Zn+2H2SO4(浓)ZnSO4+SO2↑+2H2O Zn+2H+Zn2++H2↑ 0.3 mol
【解析】
(1)①E为红棕色气体,则E为NO2, X、Y、Z、E、F均含有同一元素,则X为NH3,Y为N2,Z为NO, F为HNO3,Q为O2,据此分析;
②若Y为淡黄色固体单质,则Y为S,Q为O2,Z→E为SO2与O2反应,据此分析;
(2)①盐酸中的氢是+1价,是氢的最高价,可以得到电子变成低价,而表现氧化性;盐酸中的氯是-1价,是氯的最低价,它可以失去电子变成高价,而表现还原性;MnO2与浓盐酸反应,随着反应不断进行,盐酸的浓度不断降低,当低于某一浓度时,反应不再进行,据此解答;
②反应开始时的硫酸是浓硫酸,具有强氧化性,其还原产物为SO2,因为锌粉足量,所以反应结束时的硫酸是稀硫酸,其中H+表现出弱氧化性,其还原产物为H2,据此分析;
③依据氧化还原反应守恒规律分析。
(1)①E为红棕色气体,则E为NO2,由于NO2能与水反应,密度比空气大,因此不能用排水法,用向上排空气法收集;X、Y、Z、E、F均含有同一元素,X分子含有10个电子,则X为NH3,NH3的水溶液中存在氨气和水的反应,以及一水合氨的电离平衡,同时存在水的电离平衡,所以存在的离子有OH-、NH4+、H+,
故答案为:向上排空气法;OH-、NH4+、H+;
②若Y为淡黄色固体单质,则Y为S,Q为O2,Z→E的化学反应方程式为:2SO2+O2![]() 2SO3,
2SO3,
故答案为:2SO2+O2![]() 2SO3;
2SO3;
(2)①盐酸中的氢由+1得到电子降低变成0价的H2时,盐酸表现氧化性,被还原得到的还原产物是H2。若足量的MnO2与100mL12mol·L-1的浓盐酸反应,即0.12mol浓盐酸参与反应,由方程式![]() 可知,每反应4mol浓盐酸,生成1mol Cl2,则0.12mol浓盐酸参与反应时,生成0.3 mol Cl2,但随着反应不断进行,盐酸的浓度不断降低,当低于某一浓度时,反应不再进行,因此生成Cl2的物质的量小于0.3mol,
可知,每反应4mol浓盐酸,生成1mol Cl2,则0.12mol浓盐酸参与反应时,生成0.3 mol Cl2,但随着反应不断进行,盐酸的浓度不断降低,当低于某一浓度时,反应不再进行,因此生成Cl2的物质的量小于0.3mol,
故答案为:H2;小于;
②反应开始时的硫酸是浓硫酸,具有强氧化性,其还原产物为SO2,方程式为:Zn+2H2SO4(浓)ZnSO4+SO2↑+2H2O;因为锌粉足量,所以反应结束时的硫酸是稀硫酸,其中H+表现出弱氧化性,其还原产物为H2,反应的离子方程式为:Zn+2H+Zn2++H2↑,
故答案为:Zn+2H2SO4(浓)ZnSO4+SO2↑+2H2O;Zn+2H+Zn2++H2↑;
③6.4g铜的物质的量为0.1mol,标准状况下2.24L NO和NO2气体混合气体的总物质的量为0.1mol,按照铜原子守恒,可知,生成Cu(NO3)2的物质的量为0.1mol,按照氮原子守恒,产物中共含有0.3 molN,消耗HNO3的物质的量为0.3 mol,
故答案为:0.3 mol。


科目:高中化学 来源: 题型:
【题目】A、B、C、D都是中学化学中常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如下(部分反应中的水已略去)。根据题意回答下列问题:
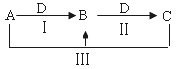
(1)若A、B、C的焰色反应均为黄色,C为厨房中的用品,D的过度排放会造成温室效应。
①A的化学式______________、B的俗名____________;
②反应II的离子方程式是__________________________________。
(2)若A、D均为单质,且A为气体,D元素的一种红棕色氧化物常用作颜料。
①反应II的离子方程式是_____________________________;
②反应Ⅲ的离子方程式是_____________________________;
③检验B中阳离子最好的方法是_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知SO2通入BaCl2溶液无明显现象。某同学利用如图装置探究SO2与BaCl2溶液反应生成白色沉淀的条件。下列判断正确的是
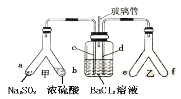
A.e、f两管中的试剂可以分别是浓氨水和NaOH固体
B.乙中产生的一定为氧化性气体,将BaSO3氧化为BaSO4沉淀
C.玻璃管的作用是连通大气,使空气中的氧气进入广口瓶,参与反应
D.c、d两根导管都必须插入BaCl2溶液中,保证气体与Ba2+充分接触
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素X、Y、Z 位于相同短周期,它们的最高及最低化合价如表所示,下列判断错误的是
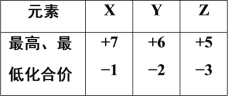
A.原子序数:X>Y>Z
B.原子半径:X>Y>Z
C.稳定性:HX>H2Y>ZH3
D.酸性由强到弱:HXO4>H2YO4>H3ZO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.向FeCl3溶液中滴加KI溶液:2Fe3++2I-=2Fe2++I2
B.向氢氧化铜悬浊液中滴加稀硫酸:OH-+H+=H2O
C.过氧化氢使酸性高锰酸钾溶液褪色:H2O2+2MnO4-+6H+=4H2O+2Mn2++3O2↑
D.向NaHCO3溶液滴加少量澄清石灰水中:2HCO3-+Ca2++2OH-=CaCO3↓+2H2O+CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学欲探究NH3催化氧化反应,按如图装置进行实验。
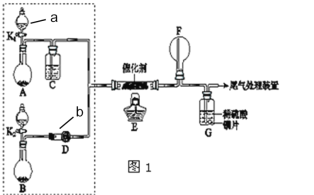
已知A、B装置可选药品:浓氨水、H2O2、蒸馏水、生石灰、MnO2。
(1)仪器a的名称为___;仪器b的名称为___。
(2)装置A烧瓶中固体的作用为___(填序号)
A.催化剂 B.氧化剂 C.还原剂 D.反应物
(3)仪器b中盛放的试剂可以是____(填序号)
A.浓硫酸 B.碱石灰 C.五氧化二磷 D.硫酸铜
(4)装置E中发生反应的化学方程式____。
(5)甲乙两同学分别按上述装置进行实验,一段时间后。
①甲观察到装置F中只有白烟生成,白烟的成分是___(写化学式)。
②乙观察到装置F中有红棕色气体,装置G中溶液变成蓝色。用离子方程式解释装置G中溶液变成蓝色的原因:___;
(6)为帮助甲实现在装置F中也观察到红棕色气体,可在原实验的基础上进行改进。你的改进措施是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知室温时,0.1mo1/L某一元酸HA在水中有0.1%发生电离,下列叙述错误的是:
A. 该溶液的pH=4 B. 升高温度,溶液的pH增大 C. 此酸的电离平衡常数约为1×10-7 D. 由HA电离出的c(H+)约为水电离出的c(H+)的106倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】瑞巴派特片是一种胃药,其主要成分结构如图。 下列关于它的说法,正确的是
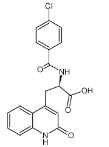
A.该物质不能使酸性高锰酸钾溶液褪色
B.该物质的分子式为 C19H17ClN2O4
C.1 mol 该物质能与 10mol 氢气发生加成反应
D.该物质能水解,水解产物中含有氨基酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某只含铁、氧两种元素的样品A,高温时与足量的CO充分反应,生成的气体被足量澄清石灰水吸收,测得沉淀的质量与原样品A质量相等。如果A中只含两种物质,则A中一定含有( )
A. FeO B. Fe2O3 C. Fe3O4 D. Fe
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com