
| 化学键 | C-H | C=C | C-C | H-H |
| 键能(kJ•mol1) | 414.4 | 615.3 | 347.4 | 435.3 |
| A. | +125.6 kJ•molˉ1 | B. | -125.6 kJ•molˉ1 | C. | +46.1 kJ•molˉ1 | D. | -46.1 kJ•molˉ1 |
分析 根据反应热=反应物的键能之和-生成物的键能之和进行计算,1molCH3CH3中含有6molC-H,1molC-C,CH2=CH2中含有4molC-H,1molC=C,1molH2含有1molH-H.
解答 解:CH3CH3→CH2=CH2+H2,1molCH3CH3中含有6molC-H,1molC-C,CH2=CH2中含有4molC-H,1molC=C,1molH2含有1molH-H,反应热=反应物的键能之和-生成物的键能之和,所以该反应的反应热=347.4+6×414.4-615.3-414.4×4-435.3=+125.6kJ/mol,
故选A.
点评 本题考查学生对反应热的计算,题目难度不大,注意掌握反应热=反应物的键能之和-生成物的键能之和.


 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
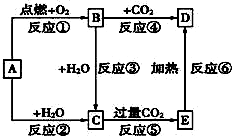 如图中,A为一种常见的单质,B、C、D、E是含有A元素的常见化合物.已知A在空气中燃烧生成淡黄色固体(部分产物已略去).
如图中,A为一种常见的单质,B、C、D、E是含有A元素的常见化合物.已知A在空气中燃烧生成淡黄色固体(部分产物已略去). 查看答案和解析>>
科目:高中化学 来源: 题型:解答题
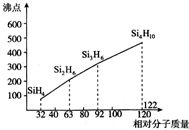 太阳能电池板材料除单晶硅外,还有铜、铟、镓、硒等化学物质.
太阳能电池板材料除单晶硅外,还有铜、铟、镓、硒等化学物质.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | t℃时,HA的Ka=10-2b/1000a/MV | |
| B. | 物质的量浓度:c(HA)=1000a/MV mol•L-1 | |
| C. | t℃时,HA的溶解度:S=100a/ρV g | |
| D. | HA的质量分数:ω(HA)=(a/ρV)×100% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 分子式为C6H6O6 | |
| B. | 乌头酸能使酸性高锰酸钾溶液褪色 | |
| C. | 含1 mol乌头酸的溶液最多可消耗3 mol NaOH | |
| D. | 乌头酸能发生水解反应和加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在密闭容器中,加入1.5mol H2和0.5mol N 2充分反应后,可得到NH3分子数为NA | |
| B. | 常温下,pH=2的醋酸溶液中所含H+的数目为0.01NA | |
| C. | 1L 0.1mol•L-1 AlCl3的溶液中所含Al3+的数目为0.1NA | |
| D. | 精炼铜时,阴极质量增加6.4g,则电路中转移的电子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应中转移电子为0.04 mol | B. | Q中n(Cu2+):n(Fe2+)=1:2 | ||
| C. | 溶液Q比原溶液增重了 1.28 g | D. | 3c(Fe3+)+2c(Fe2+)+2c(Cu2+)=0.1 mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com