
高炉炼铁中发生的基本反应之一为:FeO(s)+CO(g) Fe(s)+CO2(g)ΔH>0,已知1 373 K时K=0.263。
Fe(s)+CO2(g)ΔH>0,已知1 373 K时K=0.263。
(1)该反应的平衡常数表达式为 。
(2)温度升高,化学平衡移动后,平衡常数K值 (填“增大”、“减小”或“不变”)。
(3)1 373 K时测得高炉中c(CO2)="0.025" mol/L,c(CO)="0.1" mol/L,在这种情况下,该反应是否处于化学平衡状态 (填“是”或“否”)。此时,化学反应速率v(正) v(逆)(填“大于”、“等于”或“小于”),其原因是 。
科目:高中化学 来源: 题型:填空题
甲酸甲酯水解反应方程式为:HCOOCH3(l)+H2O(l) HCOOH(l)+CH3OH(l) ΔH>0,某小组通过实验研究该反应(反应过程中体积变化忽略不计)。反应体系中各组分的起始量如下表:
HCOOH(l)+CH3OH(l) ΔH>0,某小组通过实验研究该反应(反应过程中体积变化忽略不计)。反应体系中各组分的起始量如下表:
| 组分 | HCOOCH3 | H2O | HCOOH | CH3OH |
| 物质的量/ mol | 1.00 | 1.99 | 0.01 | 0.52 |
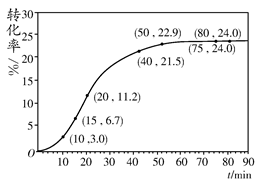
| 反应时间 范围/min | 0~5 | 10~15 | 20~25 | 30~35 | 40~45 | 50~55 | 75~80 |
| 平均反应速率 /(10-3 mol·min-1 | 1.9 | 7.4 | 7.8 | 4.4 | 1.6 | 0.8 | 0.0 |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在某一容积为5 L的密闭容器内,加入0.2mol 的CO和0.2mol的H2O(g),在催化剂存在的条件下高温加热,发生如下反应:CO(g)+H2O(g) CO2(g)+H2(g),反应放出热量。反应中CO2的浓度随时间变化的情况如下图所示。
CO2(g)+H2(g),反应放出热量。反应中CO2的浓度随时间变化的情况如下图所示。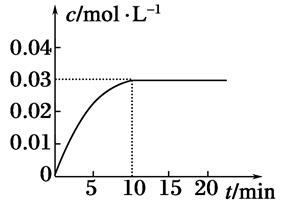
(1)根据图中数据,从反应开始至达到平衡时,CO的化学反应速率为________;反应平衡时c(H2)=________。
(2)判断该反应达到平衡的依据是________(填序号)。
| A.CO减少的化学反应速率和CO2减少的化学反应速率相等 |
| B.CO、H2O、CO2、H2的浓度都相等 |
| C.CO、H2O、CO2、H2的浓度都不再发生变化 |
| D.正、逆反应速率都为零 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)  CH3OH(g)。
CH3OH(g)。
根据题意和所给图像完成下列各题: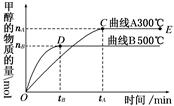
①反应达到平衡时,平衡常数表达式K=________。
②升高温度,K值________(填“增大”、“减小”或“不变”)。
(2)一定温度下,将3 mol A气体和1 mol B气体通入一密闭容器中,发生如下反应:3A(g)+B(g)??xC(g)。若容器体积固定为2 L,反应2 min时测得剩余0.6 mol B,C的浓度为0.4 mol·L-1。
请填写下列空白:
①x=________。
②平衡混合物中,C的体积分数为50%,则B的转化率是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氮及其化合物在工农业生产、生活中有着重要作用。
(1)在T℃时,将0.6molH2和0.4molN2置于容积为2 L的密闭容器中(压强为mPa)发生反应:3H2+N2 2NH3 △H<0。若保持温度不变,某兴趣小组同学测得反应过程中容器内压强随时间变化如图所示:8 min内分钟NH3的平均生成速率为 mol·L-1·min-1。
2NH3 △H<0。若保持温度不变,某兴趣小组同学测得反应过程中容器内压强随时间变化如图所示:8 min内分钟NH3的平均生成速率为 mol·L-1·min-1。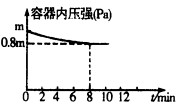
(2)仍在T℃时,将0.6molH2和0.4molN2置于一容积可变的密闭容 器中。
①下列各项能说明该反应已达到平衡状态的是 (填序号)。
a.容器内N2、H2、NH3的浓度之比为l:3:2
b.3v正(N2)=v逆(H2)
c.3v正(H2)=2v逆(NH3)
d.混合气体的密度保持不变
e.容器中气体的平均相对分子质量不随时间而变化
②该条件下达到平衡时NH3的体积分数与题(1)条件下NH3的体积分数相比 (填“变大”“变小”或“不变”)。
③达到平衡后,改变某一条件使反应速率发生了如图所示的变化,改 变的条件可能是 。
a.升高温度,同时加压
b.降低温度,同时减压
c.保持温度、压强不变,增大反应物浓度
d.保持温度、压强不变,减小生成物浓度
(3)硝酸厂的尾气含有氮氧化物,不经处理直接排放将污染空气。 氨气能将氮氧化物还原为氮气和水,其反应机理为:
2NH3(g)+5NO2(g)=7NO(g)+3H2O(g)  H=-akJ·mol-1
H=-akJ·mol-1
4NH3(g)+6NO(g)=5N2(g)+6H2O(g)  H=-bkJ·mol-1
H=-bkJ·mol-1
则NH3直接将NO2还原为N2的热化学方程式为: 。
若标准状况下NO与NO2混合气体40.32L被足量氨水完全吸收,产生标准状况下氮气42.56L。该混合气体中NO与NO2的体积之比为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
一定温度下,向一容积为5 L的恒容密闭容器中充入0.4 mol SO2和0.2 mol O2,发生反应:2SO2(g)+O2(g) 2SO3(g) ΔH="-196" kJ·mol-1。当反应达到平衡时,容器内压强变为起始时的0.7倍。请回答下列问题:
2SO3(g) ΔH="-196" kJ·mol-1。当反应达到平衡时,容器内压强变为起始时的0.7倍。请回答下列问题:
(1)判断该反应达到平衡状态的标志是 (填字母)。
a.SO2、O2、SO3三者的浓度之比为2∶1∶2
b.容器内气体的压强不变
c.容器内混合气体的密度保持不变
d.SO3的物质的量不再变化
e.SO2的生成速率和SO3的生成速率相等
(2)①SO2的转化率为 ;②达到平衡时反应放出的热量为 ;③此温度下该反应的平衡常数K= 。
(3)如图表示平衡时SO2的体积分数随压强和温度变化的曲线,则:
①温度关系:T1 T2(填“>”、“<”或“=”,下同);
②平衡常数关系:KA KB,KA KD。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2 , 化学方程式如下:2NO + 2 CO 2CO2 + N2 ,为了测定在某种催化剂作用下的反应速率,在某温度下,用气体传感器测得不同时间的NO和CO浓度如下表:
2CO2 + N2 ,为了测定在某种催化剂作用下的反应速率,在某温度下,用气体传感器测得不同时间的NO和CO浓度如下表:
| 时间 /s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/mol·L—1 | 1.00×10—3 | 4.50×10—4 | 2.50×10—4 | 1.50×10—4 | 1.00×10—4 | 1.00×10—4 |
| c(CO)/mol·L—1 | 3.60×10—3 | 3.05×10—3 | 2.85×10—3 | 2.75×10—3 | 2.70×10—3 | 2.70×10—3 |
| 实验编号 | T / ℃ | NO初始浓度 ( mol·L—1 ) | CO初始浓度 ( mol·L—1 ) | 催化剂的比表面积 ( m2·g—1 ) |
| Ⅰ | 280 | 1.20 × 10—3 | 5.80 × 10—3 | 82 |
| Ⅱ | | | | 124 |
| Ⅲ | 350 | | | 124 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
一定条件下,在体积为5 L的密闭容器中,气态物质A、B、C的物质的量n(mol)随时间t的变化如图1所示。已知达平衡后,降低温度,A的体积百分含量将减小。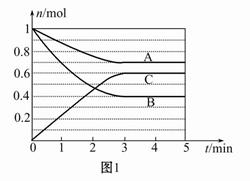
(1)根据上图数据,写出反应的化学方程式 ;
从反应开始到平衡时的平均速率v(C)= 。
(2)该反应的ΔH 0(填“>”、“<”或“=”)。
(3)此反应平衡常数的表达式为K= 。
(4)该反应的反应速率v和时间t的关系如图2所示: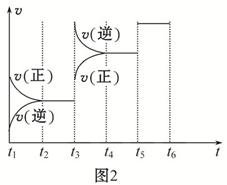
①根据上图判断,在t3时刻改变的外界条件是 。
②A的转化率最大的一段时间是 。
③各阶段的平衡常数如表所示:
K1、K2、K3之间的关系为: (用“>”、“<”或“=”连接)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
铁及其化合物在生产、生活中有广泛应用。请回答下列问题:
(1)水热法制备Fe3O4纳米颗粒的反应是:3Fe2++2S2O32-+O2+xOH-→Fe3O4↓+S4O32-+2H2O
①上述离子方程式中x=________;
②每生成1 mol Fe3O4,反应转移的电子为________mol;
(2)某高效净水剂可由Fe(OH)SO4聚合得到。工业上以FeSO4、NaNO2和稀硫酸为原料来制备Fe(OH)SO4,反应中有NO生成,化学方程式为 。
高炉炼铁过程中发生的主要反应为: Fe2O3(s)+ CO(g)
Fe2O3(s)+ CO(g) 
 Fe(s)+CO2(g)+Q
Fe(s)+CO2(g)+Q
已知该反应在不同温度下的平衡常数如下:
| 温度/℃ | 1000 | 1115 | 1300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com