
| n |
| V |
| 0.4mol |
| 0.2L |
| 1 |
| 3 |


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����ˮ��һ����ı��أ����ȡ��塢�⡢���ơ��ص�Ԫ����Ҫ�����ں�ˮ |
| B������ý�屨����ij���е����ܼ��Ƕ����彡���к������� |
| C����NO��NO2Ϊ���ĵ����������γɹ⻯ѧ�����������һ����Ҫԭ�� |
| D���ߴ��ȵĶ�������㷺�����������ά |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A�� ���� |
B�� ���������������� |
C�� ��Һ |
D�� ����Һ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��ţ�̾��ñ��ʸ��� |
| B���ղ��ù��������������ó����ֺ���ɫ�� |
| C����ú����ȼ����������Ҫ�ɷ�Ϊ���飺CH4��Ϊ�����ṩ���� |
| D���ô����ȥˮ��[��Ҫ�ɷ���CaCO3��Mg��OH��2] |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ||
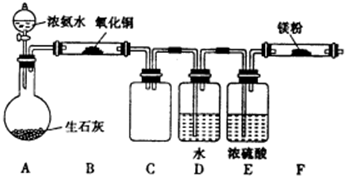
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

| ������ | Fe��OH��3 | Fe��OH��2 | Co��OH��2 | Al��OH��3 |
| ��ʼ���� | 2.3 | 7.5 | 7.6 | 3.4 |
| ��ȫ���� | 4.1 | 9.7 | 9.2 | 5.2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ѡ���Լ�������ţ� | ʵ������ | |
| ��һ�ַ��� | ||
| �ڶ��ַ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

| ���� | ʵ����� | ʵ�������� |
| 1 | ȡһ����3mol/L������Һ���Թ��У��������ȥ���ܽ����� | / |
| 2 | ȡ������Ʒ���Թ��У�����������1�����õ���Һ���ܽ⡢�����Һ | �����ܽ⣬��Һ��dz��ɫ |
| 3 | ȡ��������2��õ���Һ���Թ��У��μӼ���20%���軯����Һ���� | |
| 4 | |
| 1 |
| 10 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com