
 立方氮化硼是一种超硬材料,可由:2Mg3B2N4+3O2 $\frac{\underline{\;\;\;\;\;高温,加热\;\;\;\;\;}}{添加剂,催化剂}$6MgO+4BN+2N2制备.
立方氮化硼是一种超硬材料,可由:2Mg3B2N4+3O2 $\frac{\underline{\;\;\;\;\;高温,加热\;\;\;\;\;}}{添加剂,催化剂}$6MgO+4BN+2N2制备.分析 (1)原子数目相等、价电子总数相等的微粒互为电子;
(2)①Ni原子核外电子排布式为1s22s22p63s23p63d84s2,失去4s能级2个电子形成Ni2+;
②单键为σ的键,双键含有1个σ的键,CO(NH2)2分子中含有7个σ的键;
③同周期随原子序数增大,元素第一电离能呈增大趋势,氮元素2p能级为半满稳定状态,第一电离能大于同周期相邻元素的,故第一电离能F>N>O>C>B;
(3)晶胞中N原子处于顶点与面心,利用均摊法计算N原子数目.
解答 解:(1)原子数目相等、价电子总数相等的微粒互为电子,与N2互为等电子体的阴离子为CN-,
故答案为:CN-;
(2)①Ni原子核外电子排布式为1s22s22p63s23p63d84s2,失去4s能级2个电子形成Ni2+,Ni2+基态离子核外电子排布式为1s22s22p63s23p63d8,故答案为:1s22s22p63s23p63d8;
②单键为σ的键,双键含有1个σ的键,CO(NH2)2分子中含有7个σ的键,1mol CO(NH2)2分子中含有σ的键的数目为为7NA,故答案为:7NA;
③同周期随原子序数增大,元素第一电离能呈增大趋势,氮元素2p能级为半满稳定状态,第一电离能大于同周期相邻元素的,故第一电离能F>N>O>C>B,C、N、O三种元素的相对位置为 ,故答案为:
,故答案为: ;
;
(3)晶胞中N原子处于顶点与面心,每个晶胞中含氮原子数为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,故答案为:4.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、化学键、电离能、晶胞计算等,注意同周期第一电离能异常情况.


 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源: 题型:解答题
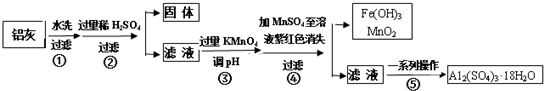
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 所含氧原子的个数比为2:3 | B. | 所含硫原子的个数比为1:1 | ||
| C. | 所含氧元素的质量比为5:6 | D. | 所含硫元素的质量比为5:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在CCl4中的溶解性Cl2<BrCl<Br2 | |
| B. | BrCl氧化性比Br2强 | |
| C. | BrCl能使润湿的淀粉碘化钾试纸变蓝 | |
| D. | 常温下BrCl可与NaOH溶液反应生成NaClO和NaBr |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 实验方法 | 观察到的现象 |
| 步骤1 | ||
| 步骤2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
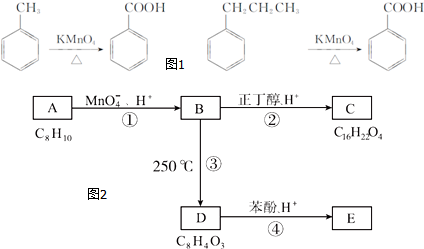
 .
. ,该反应的类型为取代反应.
,该反应的类型为取代反应.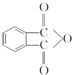 ,在D物质的核磁共振氢谱图中,会出现2组峰,峰面积之比为1:1.
,在D物质的核磁共振氢谱图中,会出现2组峰,峰面积之比为1:1.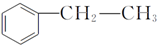 (写结构简式).
(写结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
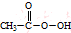 (过氧乙酸)+H2O
(过氧乙酸)+H2O查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com