
分析 (1)物质的量相等,质量之比等于摩尔质量之比;
(2)设二者的物质的量为xmol,根据二者的质量之和计算x的值,二者与盐酸恰好反应,根据电荷守恒可知,金属提供的电子的物质的量等于氯离子的物质的量,进而计算盐酸的浓度;
(3)如果反应后金属有剩余,盐酸不足,盐酸完全反应,由氢元素守恒可知要计算生成H2的体积,还需要知道盐酸的物质的量浓度.
解答 解:(1)物质的量相等,质量之比等于摩尔质量之比,故等物质的量的Mg和Al的质量之比为24g/mol:27g/mol=8:9,
故答案为:8:9;
(2)设二者的物质的量为xmol,则24x+27x=a,解得:x=$\frac{a}{51}$,二者与盐酸恰好反应,根据电荷守恒可知,金属提供的电子的物质的量等于氯离子的物质的量,故n(HCl)=$\frac{a}{51}$mol×2+$\frac{a}{51}$mol×3=$\frac{5a}{51}$mol,故盐酸的浓度为:$\frac{\frac{5a}{51}mol}{0.1L}$=$\frac{50a}{51}$mol/L,
故答案为:$\frac{50a}{51}$mol/L;
(3)H2中的氢全部来自于盐酸,所以只需知道盐酸的物质的量,就可知道生成的氢气的体积,题干中已知盐酸体积,所以只需知道盐酸的浓度即可,
故答案为:盐酸的物质的量浓度.
点评 本题考查金属混合物与酸反应的定量计算,题目难度中等,明确发生反应的原理为结构件,注意掌握守恒思想在化学计算中的应用方法,试题培养了学生的化学计算能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
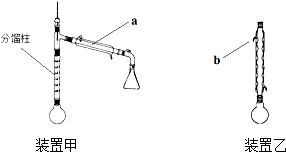 乙酰苯胺是常用的医药中间体,可由苯胺与乙酸制备.反应的化学方程式如下:
乙酰苯胺是常用的医药中间体,可由苯胺与乙酸制备.反应的化学方程式如下: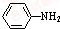 (苯胺)+CH3COOH?
(苯胺)+CH3COOH? (乙酸苯胺)+H2O
(乙酸苯胺)+H2O| 化合物 | 密度(g.cm-3) | 溶解性 | 熔点(℃) | 沸点(℃) |
| 乙酸 | 1.05 | 易溶于水、乙醇 | 17 | 118 |
| 苯胺 | 1.02 | 微溶于水,易溶于乙醇 | -6 | 184 |
| 乙酰苯胺 | - | 微溶于冷水,可溶于热水,易溶于乙醇 | 114 | 304 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
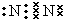 ,在这些元素中,化学性质最不活泼的是:Ar
,在这些元素中,化学性质最不活泼的是:Ar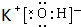 .
. .
. ,该化合物属于离子 (填“共价”或“离子”)化合物.
,该化合物属于离子 (填“共价”或“离子”)化合物.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯的结构简式CH2CH2 | |
| B. | 化学名词:乙酸乙脂、笨、油酯、坩埚 | |
| C. | 如图是某一种物质的结构简式是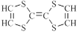 ,则该物质是一种烃 ,则该物质是一种烃 | |
| D. | 聚乙烯的化学组成表示式为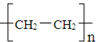 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石灰石与盐酸反应:CO32-+2H+=H2O+CO2↑ | |
| B. | 氯化铝溶液与氨水反应:Al3++3OH-=Al(OH)3↓ | |
| C. | 铁粉与硝酸银溶液反应:Fe+3Ag+=Fe3++3Ag | |
| D. | 醋酸与氢氧化钠溶液反应:CH3COOH+OH-=CH3COO-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.5g-CH3中含有的电子数为6.02×1023 | |
| B. | 标准状况下.22.4L NO和11.2L O2混合后气体的分子总数为1.0×6.02×1023 | |
| C. | 工业上用电解法精炼粗铜时,每转移1mo1电子,阳极上溶解的铜原子数必为0.5×6.02×1023 | |
| D. | VL amo1•L-1氯化铁溶液中,若Fe3+的数目为6.02×1023,则Cl-的数目大于3×6.02×1023. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com