
| A. | L层上的电子数为奇数的原子一定是主族元素的原子 | |
| B. | 元素周期表中只有第IIA元素的原子最外层有两个电子 | |
| C. | 元素周期表中第Ⅷ族分占8、9、10三列,是元素种类最多的一族 | |
| D. | 元素周期表中位于金属和非金属交界线附近的元素属于过渡元素 |
分析 A.L层上的电子数为奇数的原子,只有2个电子层;
B.原子最外层有两个电子,可能为He或某些过渡金属元素;
C.ⅢB族含锕系和镧系,元素种类最多;
D.副族和第ⅤⅢ族为过渡元素.
解答 解:A.L层上的电子数为奇数的原子,只有2个电子层,一定为第二周期的主族元素,故A正确;
B.原子最外层有两个电子,可能为He或某些过渡金属元素,不一定为第IIA元素的原子,故B错误;
C.ⅢB族含锕系和镧系,是元素种类最多的一族,故C错误;
D.副族和第ⅤⅢ族为过渡元素,均为金属元素,而金属和非金属交界线附近的元素具有金属性和非金属性,故D错误;
故选A.
点评 本题考查元素周期表的结构及应用,为高频考点,把握元素在周期表的位置、周期表的结构为解答的关键,侧重分析与应用能力的考查,注意原子的结构及族中元素种类,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 分馏石油气和裂解气可用溴水进行鉴别 | |
| B. | 异丁烷的二氯取代物有3种(不考虑立体异构) | |
| C. | 主链含四个碳的烷烃中,碳原子个数是最多的是2,3-四甲基丁烷 | |
| D. | 乙醇和甘油都含羟基,葡萄糖和蔗糖都是糖类,但它们之间不是同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
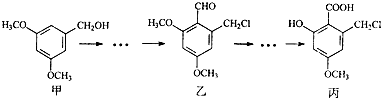
| A. | 甲、乙、丙三种有机化合物均可跟NaOH溶液反应 | |
| B. | 用FeCl3溶液区分甲、丙两种有机化合物 | |
| C. | 一定条件下丙可以与NaHCO3溶液、C2H5OH反应 | |
| D. | 乙、丙都能发生银镜反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
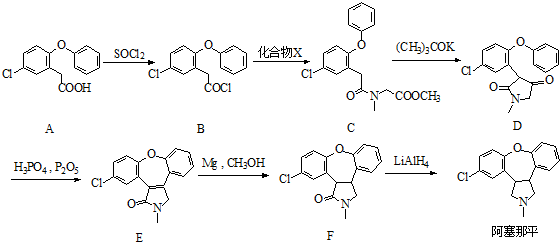
 .
. )的衍生物,且取代基都在同一个苯环上;
)的衍生物,且取代基都在同一个苯环上;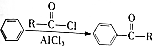 (R为烃基).根据已有知识并结合相关信息,写出以ClCH2CH2CH2Cl和
(R为烃基).根据已有知识并结合相关信息,写出以ClCH2CH2CH2Cl和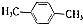 为原料制备
为原料制备 的合成路线流程图(无机试剂可任选).合成路线流程图示例如图所示:
的合成路线流程图(无机试剂可任选).合成路线流程图示例如图所示: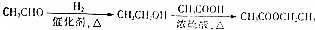
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 吸热反应不一定需要加热才能发生 | |
| B. | CO(g)的燃烧热是283.0 kJ/mol,则2CO2(g)═2CO(g)+O2(g)△H=2×283.0 kJ/mol | |
| C. | HCl和NaOH反应的中加热△H=-57.3 kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ/mol | |
| D. | 1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
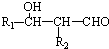
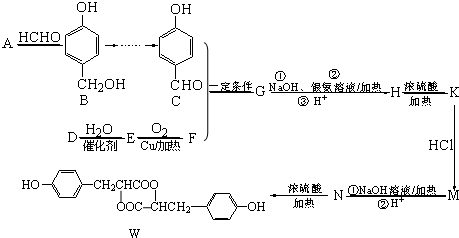
 .
.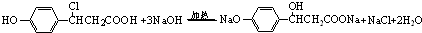 .
.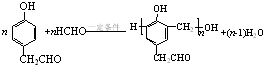 .
.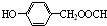 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,44 g C3H8中含有的共价键数为11 NA | |
| B. | 0.1 mol醛基中的电子数为1.5NA | |
| C. | 室温下,28.0 g乙烯和一氧化碳的混合气体中含有的碳原子数目为1.5NA | |
| D. | 标准状况下,22.4 L乙醇中含有的氧原子数为1.0NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
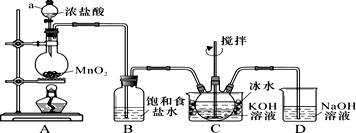
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com