
����Ŀ��ʳ�����ճ�����ı���Ʒ��Ҳ����Ҫ�Ļ���ԭ�ϡ���ʳ�γ���������Ca2+��Mg2+��Fe3+��SO42-���������ӣ�ʵ�����ᴿNaC1���������£�
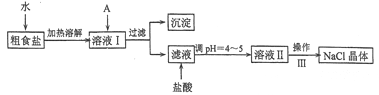
��1������A�Լ�����Ϊ�˳�ȥ��ҺI�е�Ca2+��Mg2+��Fe3+��SO42-���ӡ�A�������Ƕ����Լ������μ�˳������Ϊ:iNaOH,��__________,��_________(�ѧʽ)��
��2����д�������Լ������Լ�iʱ������Ҫ��Ӧ�����ӷ�Ӧ����ʽ��_________
��3������ͼ��ijѧ���Ĺ��˲���ʾ��ͼ����������淶����________(����)��
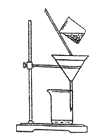
a.©��ĩ�˾���δ�����ձ���
b.��������������
c.����ֽʪ��ʹ�����©����
d.��ֽ��Ե�߳�©��
e.�ò�������©������������Լӿ�����ٶ�
��4������III��������__________
��5��mg�����ᴿ��õ�ng������NaCl���壬��m��n�Ĵ�С��ϵΪ_________.
A.m>n B. m=n C. m<n D. ��ȷ��.
��6��ʵ����������480 mL0.400mol/L���ᣬ������ͼ��ʾŨ�������ƣ��ش���������:
����
����ʽ: HCl
��Է�������: 36.5
�ܶ�: 1.2g/cm3
HCl����������Ϊ: 36.5%
��������Ҫ�IJ��������в������������ձ���________(����������)
������ȡŨ��������Ϊ:__________mL��(�������1λС��)
���𰸡� BaCl2 Na2CO3 Mg2+ + 2OH-=Mg(OH)2�� Fe3+ + 3OH-=Fe(OH)3�� de �����ᾧ D ��ͷ�ι� 500 mL ����ƿ 16.7mL
��������(1). ���ӹ�����ͨ����������ij����Լ�����Ҫ�������µ����ʣ�����ע���Ⱥ�˳����������ӿ����ñ����ӳ�ȥ����������̼������ӳ�ȥ��ͬʱ̼�������Ҳ���Գ�ȥ����ı����ӣ������ȼ��Ȼ��������̼���ơ��ʴ�Ϊ��BaCl2 ��Na2CO3 ��2�������������ƣ���þ���ӷ�Ӧ����������þ�������������ӷ�Ӧ���������������������ӷ���ʽΪ��Mg2+ + 2OH-=Mg(OH)2�� �� Fe3+ + 3OH-=Fe(OH)3�� ����3���ڹ���ʱע��һ��������������ֽ����©���ڱڣ���ֽ��Ե����©����Ե��Һ�������ֽ��Ե������������������ֽһ�࣬�ձ����ڲ�������������©���¶˾�������ձ��ڱڣ�ͬʱ���������ܽ��н��裬������d��e���淶�� ��4��������Ϊ���Ȼ�����Һ�еõ��Ȼ��ƹ��壬Ϊ�����ᾧ�� ��5��.�ڴ����ᴿ�����м����������Ӻ������ӣ����Բ���ȷ��ǰ���������ϵ���ʴ�Ϊ�� D����6��������һ�����ʵ���Ũ�ȵ���Һ��Ҫʹ�õ�������һ����������ƿ���ձ���������������ιܣ���Ͳ�ȣ�����ȱ�ٵ�Ϊ ��ͷ�ιܺ�500 mL ����ƿ������Ҫ����500mL��Һ��������Ҫ�������������㹫ʽΪ![]() ���ʴ�Ϊ��16.7mL��
���ʴ�Ϊ��16.7mL��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���й����ʵ�ת����ϵ��ͼ��ʾ���������ʺ���������ȥ����F���������B���������ɫҺ�壬A��һ�ֵ���ɫ���壬G��һ�ּ�������ǿ����������ǿ��İ�ɫ���壬C�����ֶ�����Ԫ����ɣ���Ħ������Ϊ144gmol��1 �� 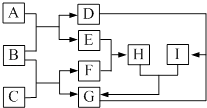
���ʴ��������⣺
��1��F�ĵ���ʽΪ ��
��2��C�Ļ�ѧʽΪ ��
��3��д��A��B��Ӧ�Ļ�ѧ����ʽ�� ��
��4��д��D��Һ��G��Ӧ�����ӷ���ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ�����KClO3�ֱ���������Ӧ:
����MnO2��������ʱ��������ȫ�ֽ�õ�����;
������ʹ�ô�����������470�����ҳ�ַ�Ӧ���õ�KClO4 (�������)��KCl��
���й��ڢٺ͢ڵ�˵������ȷ����
A. ������������ԭ��Ӧ
B. ������ԭ��Ӧ��Ԫ����ͬ
C. ����������Ӧ��Ԫ�ز�ͬ
D. ����KCl��������ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һС������Ʒ���ˮ�У�����������ȷ������ ��
A��Na����ˮ���� B��Na��ˮ�����ζ� C��Na����ˮ���� D��Na�ܳɹ���С��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ�ܰ������Ǹ��õ���ʶ���������� �ټ�������δϴ�����ɣ�����һ��ʱ�����ֺ��ɫ��ߣ�����Ҫ��ԭ��������������ʴ��
�ڳ˳���ֹЯ����Ʒ�IJ��ֱ�ʶ��ͼ��ʾ����Ũ���ᡢʳ�Ρ����͡�ʯ��������Ʒ�У�����Я���ϳ����� ��
�۹������ᣨ ![]() ���ֽ�Ϊ�������������ϡ�ܳ����ڲ;���е����������������ֽ�Ļ�ѧ����ʽ �� ijθҩ����Ҫ�ɷ���AlbMgc��OH��mCO3 �� ����������θ����࣬д��������θ�ᷴӦ�Ļ�ѧ����ʽ ��
���ֽ�Ϊ�������������ϡ�ܳ����ڲ;���е����������������ֽ�Ļ�ѧ����ʽ �� ijθҩ����Ҫ�ɷ���AlbMgc��OH��mCO3 �� ����������θ����࣬д��������θ�ᷴӦ�Ļ�ѧ����ʽ �� 
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����в�����������ȷ���ǣ� ��
A.�þƾ���ϴմ��Ƥ���ϵ���������
B.�����յķ���������ë�ߺ�����
C.������Ӧ����Թ���ϡ������ϴ
D.�÷�Һ©�����뱽�ͼױ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����״���£�ijͬѧ��100mL H2S������Һ��ͨ��SO2 �� ������ҺpH�仯��ͼ��ʾ�����з�������ȷ���ǣ� �� 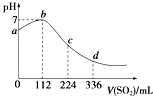
A.b���Ӧ����Һ��������ǿ
B.�������DZ��������������
C.ab�η�Ӧ��SO2+2H2S�T3S��+2H2O
D.ԭH2S��Һ�����ʵ���Ũ��Ϊ0.05molL��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵķе��ɸߵ������е��ǣ� �� ��CH3��CH2��2CH3
��CH3��CH2��3CH3
�ۣ�CH3��3CH
�ܣ�CH3��2CHCH2CH3 ��
A.�ڢܢ٢�
B.�ܢڢۢ�
C.�ܢڢ٢�
D.�ڢܢۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������
��1�������£�0.1 mol/L NaClO��Һ��pH0.1 mol/L Na2SO3��Һ��pH�� ��ѡ����ڡ�����С�ڡ����ڡ�����Ũ�Ⱦ�Ϊ0.1 mol/L ��Na2SO3��Na2CO3�Ļ����Һ�У�SO32����CO32����HSO3����HCO3�� Ũ�ȴӴ�С��˳��Ϊ ��
��֪��H2SO3 K1=1.54��10��2 K2=1.02��10��7 HClO K1=2.95��10��8
H2CO3 K1=4.3��10��7 K2=5.6��10��11
��2���ñ�����Һ�ζ�����SO2��ˮ��Һ���Բⶨˮ��SO2�ĺ�����Ӧѡ����ָʾ�����ﵽ�ζ��յ�������� ��
��3�������£���amol/lCH3COONa����ˮ�����Һ�������еμӵ����bmolL��1������ʹ��Һ�����ԣ������Ǵ��������Ļӷ������ú�a��b�Ĵ���ʽ��ʾ����ĵ���ƽ�ⳣ��Ka= ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com