
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:山东省高青一中2009-2010学年度高二上学期期末模块检测考试化学试题 题型:058
酸碱中和反应是中学化学一类重要的反应,其反应的本质都是H+和OH-反应生成H2O.某学生实验小组对课本中的两个酸碱中和实验进行了模拟研究.
(1)用下图装置进行强酸(50 mL 0.5 mol/L的HCI)和强碱(50 mL 0.55 mol/L的NaOH)反应的中和热测定.
①从实验装置上看,图中尚缺少的一种玻璃仪器是________;
②大小烧杯之间填满纸屑的作用是________;
③向组装好的量热器中加入50 mL盐酸并测定温度,取出温度计并冲
净后,再将已测定好温度的NaOH溶液50 mL加入量热器.下列加入50 mL NaOH溶液的操作正确的是________.
A.为了使酸碱充分中和,必须边滴加NaOH溶液边迅速搅拌
B.把50 mL NaOH溶液一次迅速倒入,盖上纸板迅速搅拌.
④若用醋酸代替上述盐酸实验,实验测得的中和热值________(填偏大、偏小或无影响).
(1)、用实验室准确配制的0.100 mol/L的NaOH溶液测定某未知浓度的稀盐酸.
其具体实验步骤如下:
①取一支碱式滴定管下图中有两只滴定管~上端未画出,你选择哪一只?________(填写对应字母),用少量标准NaOH溶液润洗2~3次水洗后的碱式滴定管,再加入标准的0.100 mol/L的NaOH溶液并记录液面刻度读数;
②用酸式滴定管精确的放出25.00 mL待测盐酸,置于用蒸馏水洗净的锥形瓶中,再加入酚酞(变色范围:8.2~10.0)试液2滴;
③滴定时,边滴边振荡,同进注视眼睛注视锥形瓶内容也颜色的变化,当锥形瓶内溶液由________(填写颜色变化)且半分钟内不褪色时,即达到滴定终点;
④记录液面刻度读数.根据滴定管的两次读数得出消耗标准盐酸的体积,再重复测定两次,实验结果记录见下表:

测得未知稀盐酸的物质的量浓度为________(保留小数点后3位).
⑤如果滴定结束时俯视碱式滴定管刻度读数(其它操作均正确),则对滴定结果~稀盐酸浓度的影响是________(填“偏高”、“偏低”或“无影响”).
查看答案和解析>>
科目:高中化学 来源:2009年山东省高考理综化学模拟题3 题型:022
下列实验操作或对实验事实的叙述错误的是________(填序号).
①用氨水清洗做过银镜反应的试管;
②用分液漏斗分离硝基苯和水的混合物;
③配制100 mL 1.00 mol·L-1的NaCl溶液时,用托盘天平称取5.85 g NaCl固体;
④用酸式滴定管量取25.00 mL 1 mol/L的酸性高锰酸钾溶液;
⑤在实验室中,烧碱、胆矾等固体的熔化或分解实验通常在陶瓷坩埚中进行;
⑥配制FeSO4溶液时,需加入少量铁粉和稀硫酸;
⑦鉴别失去标签的烧碱、石灰石、硝酸铵和食盐四种固体,只需水一种试剂;
⑧在进行酸碱中和滴定实验时,为了准确的判断是否达到滴定终点,眼睛一定要注意观察滴定管中液面的变化.
⑨在测定中和热的实验时,用环形玻璃搅拌棒进行搅拌,目的是为了防止热量散失和溶液均匀混合.
查看答案和解析>>
科目:高中化学 来源: 题型:
A.在250 mL的容量瓶中定容配制250 mL烧碱溶液
B.用移液管移取25 mL烧碱溶液于锥形瓶中,并滴入几滴甲基橙作指示剂
C.在托盘天平上准确称取烧碱样品W g,在烧杯中用蒸馏水溶解
D.将物质的量浓度为c mol·L-1的标准硫酸溶液装入已润洗过的酸式滴定管中,调整液面并记下起始读数为V1 mL
E.在锥形瓶下垫一张白纸,滴定至橙色为止,记下读数为V2 mL
就此完成下列问题:
(1)正确操作步骤是(用编号字母填空)_________→_________→_________→D→_________。
(2)观察滴定管里液面的高度时应注意:____________________________________。
(3)E步骤的操作中在锥形瓶下垫一张白纸的作用是___________________________。
(4)D步骤的操作中液面应调整到_________,尖嘴部分应该__________________。
(5)某学生实验时把锥形瓶用待测烧碱溶液润洗,则测定的烧碱溶液的浓度偏高还是偏低_________;原因是____________________________________。
(6)该烧碱样品纯度的计算公式是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
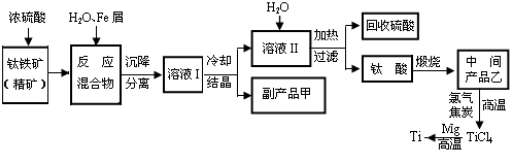
为了测定某种含有Na2O杂质的Na2O2试样的纯度,3个课外活动小组分别设计了如下三个实验方案。首先准确称量出要进行反应的样品的质量m g,然后,将按照以下方案进行实验:
方案一:将样品与水充分反应,使产生的气体与加热的铜粉充分反应,测定反应后生成的氧化铜的质量为n g,通过计算求出试样中的含量。
(1)按照此方案,则试样中Na2O2的含量为 (用含 m、n的式子表示)
a(Na2O2)% ==
(2)此方案测定的结果误差较大,主要原因是:
方案二:将样品与实验生成的二氧化碳反应,通过测定反应产生的气体的体积,计算求出试样中Na2O2的含量。
(1)按照此方案,以下制取二氧化碳和进行反应使用的仪器的连接次序是
(填写仪器的编号)
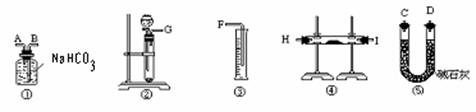
(2)通过①仪器的气体从流向上看,次序为 进 出(填写导管的字母)
方案三:将样品与水充分反应,测定出反应后的溶液的准确体积VL,因为体积较大,再从反应后的溶液中,取一定的准确的体积为V1ml溶液,装入锥形瓶中,用标准浓度的盐酸进行滴定,测定出样品与水反应后所得到的溶液的浓度,再计算求出试样中Na2O2的含量。
(1) 按照此方案,进行酸碱中和滴定时,最后一步操作应该选择的下列仪器中的
(填写仪器的编号)


(2)选择甲基橙做指示剂,确定终点的现象应该是溶液颜色由 变 并且半分钟内不变你认为方案二、方案三中测定结果最准的是
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com