
 .
. .
. 分析 A、B、C、D、E都是短周期主族元素,它们的核电荷数依次增大,元素A的原子核内仅有一个质子,则A为H元素;E与C同主族,E的质子数为C的2倍,则C为O元素、E为S元素;B、C为同周期相邻元素,B的原子序数较小,则B为N元素;元素D的最外层电子数比K层电子数多1,最外层电子数为3,原子序数大于氧元素,故D为Al元素,据此进行解答.
解答 解:A、B、C、D、E都是短周期主族元素,它们的核电荷数依次增大;元素A的原子核内仅有一个质子,则A为H元素;E与C同主族,E的质子数为C的2倍,则C为O元素、E为S元素;B、C为同周期相邻元素,B的原子序数较小,则B为N元素;元素D的最外层电子数比K层电子数多1,最外层电子数为3,原子序数大于氧元素,故D为Al元素,
(1)由上述分析可知,A为H,C为O,D为Al,
故答案为:H;O;Al;
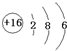
(2)E为硫元素,核电荷数=核外电子总数=16,最外层含有6个电子,其原子结构示意图为: ,
,
故答案为: ;
;
(3)由上述元素组成的具有漂白作用的三种物质的化学式为:O3、H2O2、SO2,
故答案为:O3;H2O2;SO2;
(4)A、E分别为H、S,二者形成的化合物为硫化氢,其分子中存在两个H-S键,用电子式表示其形成过程为: ,
,
故答案为: .
.
点评 本题考查了位置、结构与性质的关系,题目难度中等,推断元素为解答关键,注意掌握原子结构与元素周期律、元素周期表的关系,试题侧重考查学生的分析能力及逻辑推理能力.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 内容 | NaOH溶液 | 银氨溶液 | 新制Cu(OH)2 | 金属钠 |
| A | 发生水解 | 无银镜反应 | 不反应 | 不反应 |
| B | 发生中和反应 | 无银镜反应 | 溶解 | 放出H2 |
| C | 不反应 | 有银镜反应 | 有红色沉淀 | 放出H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 多用电子邮件、MSN、QQ等即时通讯工具,少用传真打印机属于“低碳生活”方式 | |
| B. | 为加快漂白精的漂白速率,使用时可滴加几滴醋酸 | |
| C. | 我国神七宇航员所穿航天服主要成分是由碳化硅、陶瓷和碳纤维复合而成的,它是一种新型无机非金属材料 | |
| D. | 视频《穹顶之下》再次引起公众对“PM2.5”的关注.“PM2.5”是指大气中直径小于或等于2.5×10-6m的细小颗粒物,这些颗粒扩散在空气中形成胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.3 mol•L-1 的NH4NO3溶液中含有的NO-3数目为0.3NA | |
| B. | 常温常压下,5.6gC2H4和C3H6的混合气体中含氢原子数为0.9NA | |
| C. | 将标准状况下11.2L的Cl2通入足量水中,转移的电子总数为0.5NA | |
| D. | 一定量的Fe与含1 mol HNO3的稀硝酸恰好反应,则被还原的氮原子数小于NA |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ; EB4
; EB4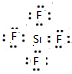 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 已知X的电负性在同主族元素中最大,其基态原子最外电子层的p轨道呈半充满状态.回答下列问题:
已知X的电负性在同主族元素中最大,其基态原子最外电子层的p轨道呈半充满状态.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:推断题
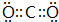 ,B与D形成的原子个数比为l:l的化合物中含有的化学键类型有离子键和共价键.
,B与D形成的原子个数比为l:l的化合物中含有的化学键类型有离子键和共价键.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com