
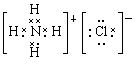 (1分) H++AlO2–+H2O
(1分) H++AlO2–+H2O Al(OH)3
Al(OH)3 Al3++3OH–(2分)
Al3++3OH–(2分) 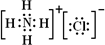 。氢氧化铝是两性氢氧化物,其电离方程式为H++AlO2-+H2O
。氢氧化铝是两性氢氧化物,其电离方程式为H++AlO2-+H2O Al(OH)3
Al(OH)3 Al3++3OH-。
Al3++3OH-。

科目:高中化学 来源:不详 题型:填空题
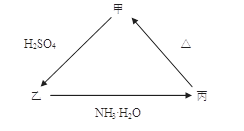
 丙的离子方程式______________________; 丙
丙的离子方程式______________________; 丙 甲的化学方程式____________________。
甲的化学方程式____________________。 乙的离子方程式是_____________________________。
乙的离子方程式是_____________________________。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 8Cu+4FeO+2Fe2O3+16SO2反应制取铜及其硫和铁的化合物。
8Cu+4FeO+2Fe2O3+16SO2反应制取铜及其硫和铁的化合物。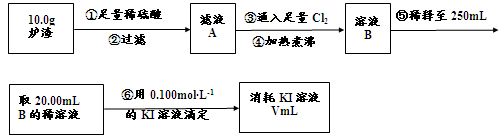
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
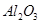 ,含
,含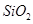 、
、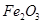 等杂质)中提取氧化铝的工艺做实验,流程如下:
等杂质)中提取氧化铝的工艺做实验,流程如下: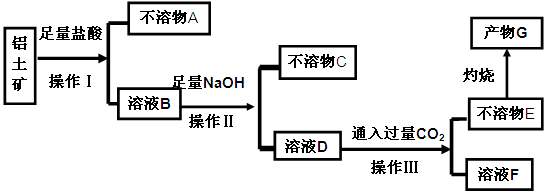
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
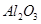 ,含
,含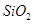 、
、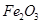 、MgO等杂质)中提取两种工艺品的流程如下:
、MgO等杂质)中提取两种工艺品的流程如下: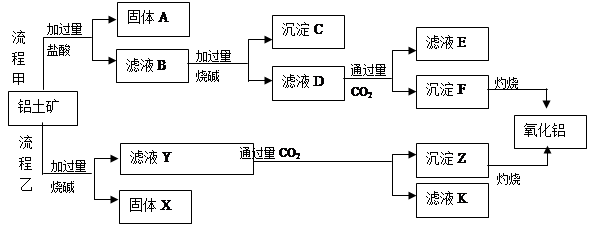
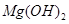 的溶度积常数
的溶度积常数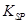 =10-11,取适量的滤液B,加入一定量的烧碱恰使镁离子沉淀完全,则溶液的PH最小为_______.
=10-11,取适量的滤液B,加入一定量的烧碱恰使镁离子沉淀完全,则溶液的PH最小为_______.查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 元素 | 钠 | 镁 | 铝 | 硅 |
| 电负性 | 0.9 | 1.2 | χ | 1.8 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
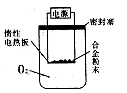
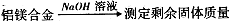 。
。
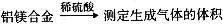 。
。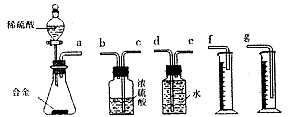
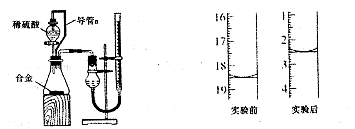
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
| 实验序号 | a | b | c |
| 合金质量(mg) | 510 | 765 | 918 |
| 气体体积(mL) | 560 | 672 | 672 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
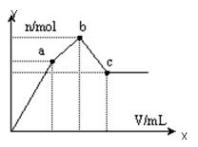
| A.a点对应的沉淀只有BaSO4 |
| B.c点溶液呈碱性 |
| C.b点发生反应的离子方程式是:Al3++2SO42-+2Ba2++3OH-=Al(OH)3↓+2BaSO4↓ |
| D.c点加入Ba(OH)2溶液的体积为200 mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com