
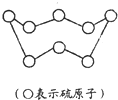
 用NA表示阿伏加德罗常数的值,下列叙述正确的是
用NA表示阿伏加德罗常数的值,下列叙述正确的是 计算物质的量结合分子式计算氢原子数;
计算物质的量结合分子式计算氢原子数;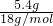 =0.3mol,分子中含氢原子数为0.6NA,故A错误;
=0.3mol,分子中含氢原子数为0.6NA,故A错误;

 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com