
(10分)下图是中学常见物质间的转化关系。已知:(a)A为淡黄色固体,B为导致“温室效应”的主要物质; (b)E为常见金属,J为红褐色沉淀;(c)G在实验室中常用于检验B的存在;(d)L是一种重要的工业原料,常用于制造炸药,浓溶液常呈黄色。
回答下列问题:
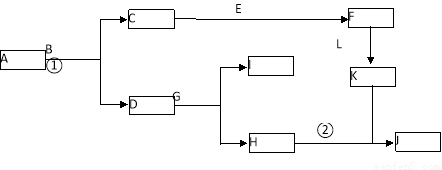
(1)A的电子式 。
(2)反应①的化学方程式为 ,反应②的离子方程式为
(3)若参加反应的A的质量为39g,则转移的电子数目为 。
(4)向含n g L的稀溶液中加入m g E,两者恰好完全反应,若L只被还原为+2价化合物,则n∶m不可能为 。
A.5∶1 B.9∶2 C.3∶1 D.4∶1
(10分)(1) Na+[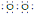 ]2-Na+ ;
]2-Na+ ;
(2) 2Na2O2+2CO2 =2Na2CO3+O2; Fe3++3OH—=Fe(OH)3↓;
(3) 3.01ⅹ1023
(4) A
【解析】
试题分析:由题意可知,B是二氧化碳气体,与二氧化碳反应的淡黄色固体是过氧化钠,所以A是过氧化钠,C是氧气,D是碳酸钠,则G是氢氧化钙,J是氢氧化铁,H是氢氧化钠,E是常见金属,则E是Fe,铁与氧气反应生成四氧化三铁,四氧化三铁与浓硝酸反应生成硝酸铁,硝酸铁与氢氧化钠反应生成氢氧化铁沉淀,所以L是硝酸,K是硝酸铁。
(1)根据以上分析,A是过氧化钠,是离子化合物,电子式为Na+[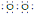 ]2-Na+ ;
]2-Na+ ;
(2)反应①是过氧化钠与二氧化碳反应生成碳酸钠和氧气,化学方程式为2Na2O2+2CO2 =2Na2CO3+O2;反应②是氢氧化钠与硝酸铁反应生成氢氧化铁沉淀,离子方程式为Fe3++3OH—=Fe(OH)3↓;
(3)39g的过氧化钠的物质的量是0.5mol,在与二氧化碳的反应中过氧化钠有一半作还原剂,一半作氧化剂,所以转移电子的数目是0.5mol×2×1/2×NA=3.01ⅹ1023;
(4)由题意可知硝酸钡还原为NO,若Fe与硝酸反应生成硝酸亚铁,则被还原的硝酸的物质的量是m/56×2/3=m/84mol,未被还原的硝酸的物质的量是m/56×2=m/28mol,硝酸的总物质的量是n/63mol,所以n/63=m/84+m/28,解得n:m=3:1;若Fe与硝酸反应全部生成硝酸铁,则被还原的硝酸的物质的量是m/56mol,未被还原的硝酸的物质的量是m/56×3mol,则m/56+m/56×3=n/63,解得n:m=63:14=9:2,实际的n:m的值介于二者之间,所以3≤n:m≤9/2,B、C、D均符合,A>9/2,所以A不可能,答案选A。
考点:考查对无机推断的分析,电子式的书写,氧化还原反应的计算,极端假设法的应用


科目:高中化学 来源:2014-2015学年湖南邵阳县石齐学校高二上第一次月考化学(理)试卷(解析版) 题型:选择题
对于任何一个平衡体系,采用以下措施,一定会使平衡移动的是
A.加入一种反应物 B.升高温度 C.对平衡体系增加压强 D.使用催化剂
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省高三上学期第二次月考化学试卷(解析版) 题型:填空题
(12分)A、B、D、E、F为短周期元素,非金属元素A最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍。B在D中充分燃烧能生成其最高价化合物BD2。E+与D2-具有相同的电子数。A在F中燃烧,发出苍白色火焰,产物溶于水得到一种强酸。回答下列问题:
(1)写出一种工业制备单质F的化学方程式:__________________________________________。
(2)B、D、E组成的一种盐中,E的质量分数为43%,其俗名为___________, 请用离子方程式解释该溶液呈碱性的原因____________________________________________;
(3)实验室用F从含碘废液(除H2O外,含有CCl4、I2、I-等)中回收碘,其实验过程如下:
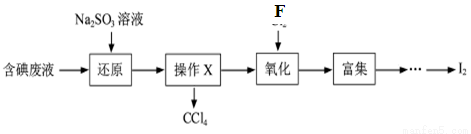
①向含碘废液中加入稍过量的Na2SO3溶液,将废液中的I2还原为I-,其离子方程式为_____________ ;
②操作X的名称为___________________。
③已知:5SO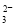 +2IO
+2IO +2H+===I2+5SO
+2H+===I2+5SO +H2O,某含碘废水(pH约为8)中一定存在I2,可能存在I-、IO
+H2O,某含碘废水(pH约为8)中一定存在I2,可能存在I-、IO 中的一种或两种。请补充完整检验含碘废水中是否含有I-、IO
中的一种或两种。请补充完整检验含碘废水中是否含有I-、IO 的实验方案:取适量含碘废水用CCl4多次萃取、分液,直到水层用淀粉溶液检验没有碘单质存在;___________________________________;
的实验方案:取适量含碘废水用CCl4多次萃取、分液,直到水层用淀粉溶液检验没有碘单质存在;___________________________________;
另从水层取少量溶液,加入1~2 mL淀粉溶液,加盐酸酸化,滴加Na2SO3溶液,若溶液变蓝,说明废水中含有IO ;若溶液不变蓝,说明废水中不含有IO
;若溶液不变蓝,说明废水中不含有IO 。
。
(实验中可供选择的试剂:稀盐酸、淀粉溶液、FeCl3溶液、Na2SO3溶液。)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省高三上学期第二次月考化学试卷(解析版) 题型:选择题
NA表示阿伏伽德罗常数,下列叙述正确的是( )
A.O2和O3共32 g混合物中氧原子的个数为2NA
B.78 g苯含有C===C 键的数目为3NA
C.1 mol Na2O2固体中含离子总数为4NA
D.足量Fe与1 mol 氯气反应时转移的电子数为3NA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省高三上学期第二次月考化学试卷(解析版) 题型:选择题
下列有关物质的性质和应用均正确的是( )
①氯气具有酸性,可与烧碱或石灰乳反应制备含氯消毒剂,84消毒液的有效成分是NaClO
②浓硫酸具有强氧化性,不能干燥SO2等还原性的气体;过氧化钠具有强氧化性,可用作潜水艇中氧气的来源
③硅在元素周期表中处于金属与非金属的交界位置,是重要的半导体材料,在自然界中可以以游离态和化合态的形式存在
④浓氨水可检验氯气管道是否漏气
⑤玻璃容器可长期盛放各种酸
⑥Na2S可除去污水中的Cu2+
⑦碘酒是指单质碘的乙醇溶液
⑧明矾作净水剂,液氨用作制冷剂,生石灰作干燥剂
A.①④⑦⑧ B.④⑥⑦⑧ C.②⑦⑧ D.②③⑦⑧
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省高三上学期第一次月考化学试卷(解析版) 题型:选择题
在100ml含等物质的量的HBr和H2SO3的溶液中通入0.025molCl2,有一半Br-变为Br2(已知Br2 能氧化H2SO3)。则原溶液中HBr和H2SO3的浓度都等于
A.0.16mol/L B.0.02mol/L C.0.20mol/L D.0.25mol/L
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省高三上学期第一次月考化学试卷(解析版) 题型:选择题
下列离子方程式书写正确的是
A.FeCl2溶液中通入氯气:Fe2++Cl2 = Fe3++2Cl-
B.澄清石灰水与少量小苏打溶液混合:Ca2++OH-+HCO3-= Ca CO3↓+H2O
C.FeS固体放入稀硝酸溶液中:FeS+2H+= Fe2++H2S↑
D.碳酸氢镁和足量的氢氧化钙溶液反应:Ca2++OH-+HCO3-=Ca CO3↓+H2O
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省浏阳市高一上第一次月考试卷化学试卷(解析版) 题型:填空题
(12分)实验室需要0.1 mol/L的硫酸920 mL,某同学欲用密度为1.84 g/cm3、溶质的质量分数为98%的浓硫酸进行配制。试回答:
(1)需选用_________容量瓶(填序号)。
A.50 mL B.100 mL C.250 mL D.1000 mL
(2)需量取98%浓硫酸的体积为__________mL。
(3)下列关于容量瓶的使用方法中,正确的是________(填序号)。
A.使用前要检验是否漏水
B.在容量瓶中直接溶解固体或稀释液体
C.溶液未经冷却即注入容量瓶中
D.向容量瓶中转移溶液时,用玻璃棒引流
(4)导致浓度偏低的原因可能是________(填序号)。
A.容量瓶中原有少量的蒸馏水
B.移液时,不慎将液体流到瓶外
C.容量瓶盛过硫酸溶液,使用前未洗涤
D.定容时俯视刻度线和液面
E.未洗涤烧杯、玻璃棒
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com