

| A.含有18e-的两种氢化物中只存在极性键 |
| B.氢化物的沸点大小是H2O<H2S<H2Se<H2Te |
| C.a所对应的氢化物是H2O |
| D.每1mol H2S分解会吸收20KJ的热量 |
科目:高中化学 来源:不详 题型:单选题
| A.HF、HCl、HBr、HI的热稳定性和还原性从左到右依次减弱 |
| B.O2―半径比F―的小 |
| C.Na和Cs属于第ⅠA族元素,Cs失电子能力比Na的强 |
| D.第三周期非金属元素含氧酸的酸性从左到右依次增强 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.原子半径:H<Al<Mg<Na |
| B.热稳定性:HCl<H2S<PH3 |
| C.P、S、Cl元素最高价氧化物对应的水化物酸性依次增强 |
| D.N、O、F元素非金属性依次增强 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 C D
C D 查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 —、Cl—、NO3—中的一种或几种,取该溶液进行连续实验,实验过程如下:
—、Cl—、NO3—中的一种或几种,取该溶液进行连续实验,实验过程如下: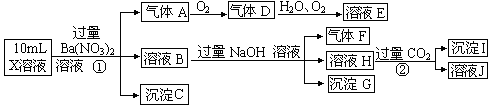
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 转化关系(省略了水和部分反应物及生成物),除反应②外,其他反应均在溶液中进行。D是工业中最常用的金属。
转化关系(省略了水和部分反应物及生成物),除反应②外,其他反应均在溶液中进行。D是工业中最常用的金属。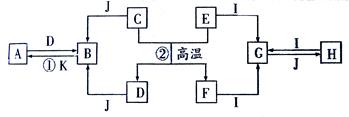
 。
。| T(℃) | 200 | 600 | 800 |
| ρ(g/L) | 6.881 | 2.650 | 1.517 |
| 气体摩尔体积(L/mol) | 38.8 | 71.6 | 88.0 |
 00℃时无水H 存在形式的分子式为 。
00℃时无水H 存在形式的分子式为 。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com