

分析 (1)①依据化合价代数和为0,来解答;H3PO2和AgNO3溶液反应进行化学镀银,此反应中氧化剂与还原剂的物质的量之比为4:1,结合化合价的判断产物,以此书写反应的离子方程式;
②根据H3PO2是一元中强酸,可以判断NaH2PO2为正盐;
(2)①根据阳极中阴离子为硫酸根离子、氢氧根离子和H2PO2-,判断放电能力强弱,然后写出阳极的电极反应式;
②根据图示“四室电渗析法”工作原理分析产品室可得到H3PO2的原因.
解答 解:(1)①H3PO2中,氢元素为+1价,氧元素为-2价,依据化合价代数和为0,磷化合价为+1价;该反应中Ag+为氧化剂,H3PO2为还原剂,氧化剂与还原剂的物质的量之比为4:1,设反应产物中P的化合价为x,根据化合价升降相等可得,4×(1-0)=1×(x-1),解得x=5,所以氧化产物为+5价的H3PO4,
故答案为:+1;H3PO4;
②由于H3PO2是一元中强酸,所以NaH2PO2为一元强碱和一元中强酸形成的正盐,
故答案为:正盐;
(2)①由于阳极中阴离子为硫酸根离子、氢氧根离子和H2PO2-,其中放电能力最强的是氢氧根离子,则阳极发生的电极反应为:4OH--4e-=O2↑+2H2O;
故答案为:4OH--4e-=O2↑+2H2O;
②产品室可得到H3PO2的原因是因为:阳极室的H+穿过阳膜扩散至产品室,原料室的H2PO2-穿过阴膜扩散至产品室,二者反应生成H3PO2,反应为:H++H2PO2-=H3PO2,
故答案为:H++H2PO2-=H3PO2.
点评 本题考查了氧化还原反应、电解等知识,题目难度不大,掌握电解原理的应用是解答关键.


 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:选择题
| A. | 苯在常温下可与溴水发生取代反应 | |
| B. | 葡萄糖能发生氧化反应和银镜反应 | |
| C. | 乙醇和乙酸都能与氢氧化钠反应 | |
| D. | 糖类、油脂和蛋白质都能发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;Na2O2与SO2反应的化学方程式为2Na2O2+2SO2═2Na2SO4.
;Na2O2与SO2反应的化学方程式为2Na2O2+2SO2═2Na2SO4.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
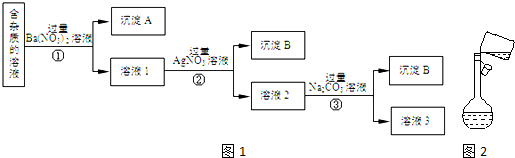
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
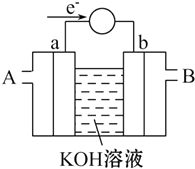 能源问题是当前人类社会面临的一项重大课题,H2、CO、CH3OH都是重要的能源物质,它们的燃烧热依次为285.8kJ/mol、282.5kJ/mol、726.7kJ/mol.请回答:
能源问题是当前人类社会面临的一项重大课题,H2、CO、CH3OH都是重要的能源物质,它们的燃烧热依次为285.8kJ/mol、282.5kJ/mol、726.7kJ/mol.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
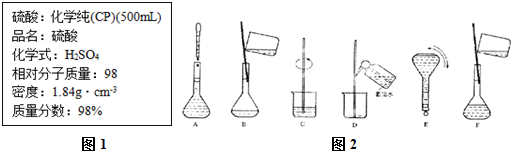
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验方法 | 现象 | 结论 |
| 向某溶液加入AgNO3溶液 | 出现白色沉淀 | 原溶液中一定有Cl- | |
| 向某溶液加入BaCl2溶液 | 出现白色沉淀 | 原溶液中一定有SO42- | |
| 向某溶液加入NaOH溶液 | 出现蓝色沉淀 | 原溶液中一定有Cu2+ | |
| 向某溶液加入H2SO4溶液 | 产生无色无味气体 | 原溶液中一定有CO32- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑ | B. | H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl | ||
| C. | 2HCl+Zn═ZnCl2+H2↑ | D. | NaCl+AgNO3═AgCl↓+NaNO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com